Содержание
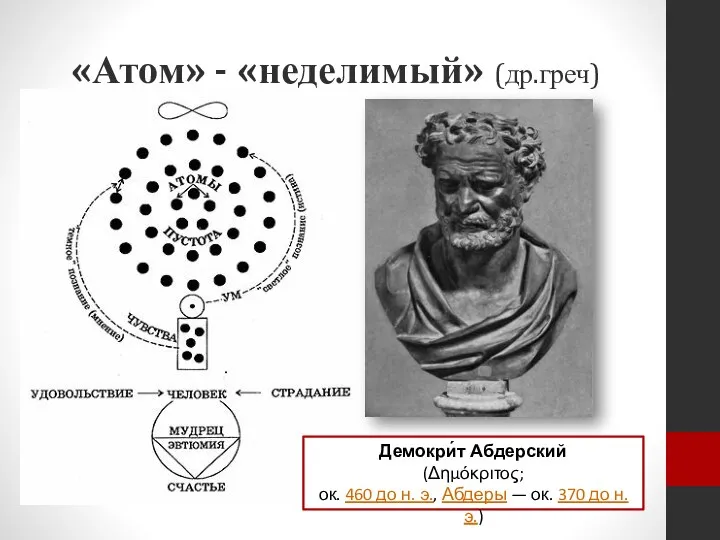
- 2. «Атом» - «неделимый» (др.греч) Демокри́т Абдерский (Δημόκριτος; ок. 460 до н. э., Абдеры — ок. 370
- 3. Сложность строения доказана фундаментальными открытиями (XIX – XX в)
- 4. ПРЕДПОСЫЛКИ Развития учения о строении атома
- 5. Открытие радиоактивности В 1886 году французский физик А. Беккерель при изучении урановых руд открыл радиоактивность (от
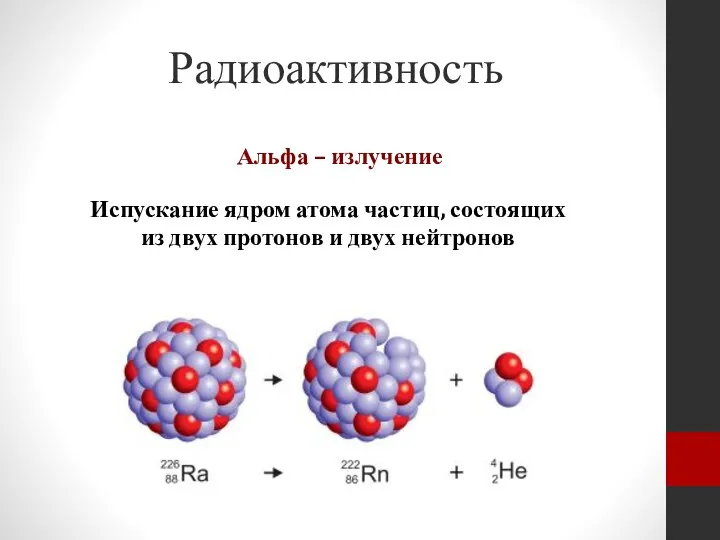
- 6. Радиоактивность Альфа – излучение Испускание ядром атома частиц, состоящих из двух протонов и двух нейтронов
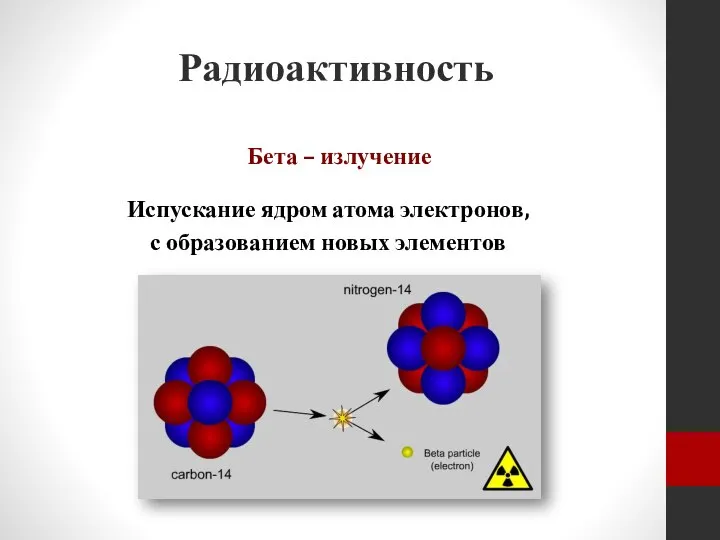
- 7. Радиоактивность Бета – излучение Испускание ядром атома электронов, с образованием новых элементов
- 8. Открытие явления фотоэффекта Внешний фотоэффект был открыт в 1887 г Генрихом Герцем А.Г. Столетов 1888-1890 гг
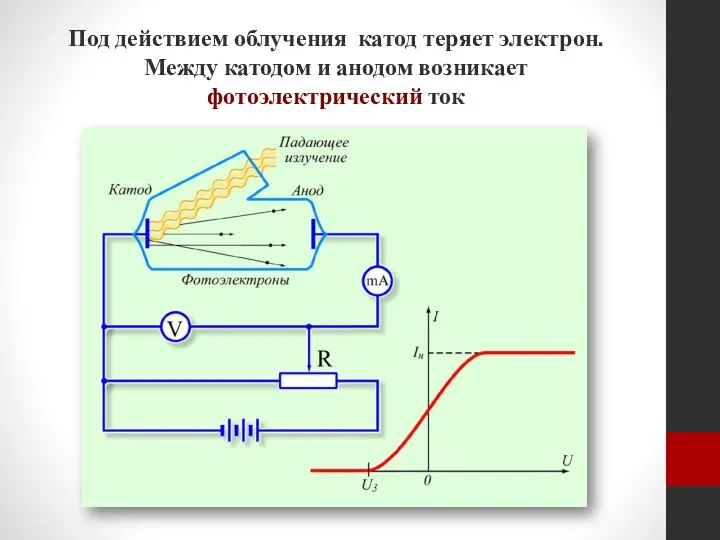
- 9. Под действием облучения катод теряет электрон. Между катодом и анодом возникает фотоэлектрический ток
- 10. Открытие электрона Катодная трубка Томсона В 1897 г. английский физик Дж. Томсон, проводя опыты с газоразрядной
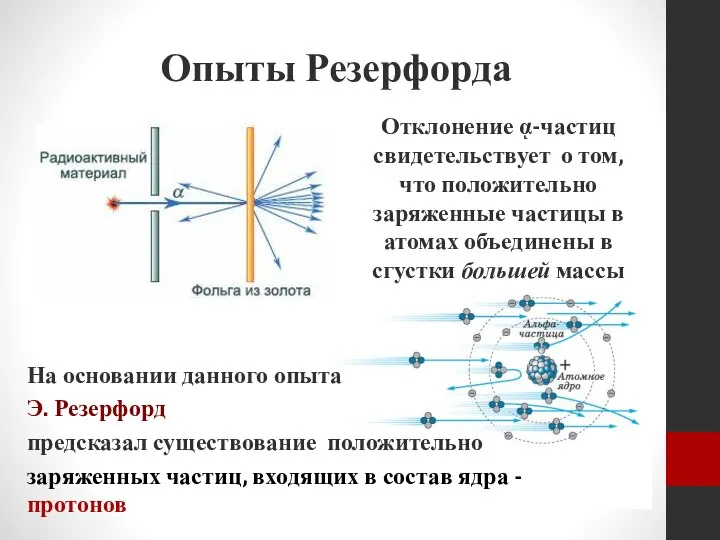
- 11. Опыты Резерфорда Отклонение ᾳ-частиц свидетельствует о том, что положительно заряженные частицы в атомах объединены в сгустки
- 12. Открытие нейтронов В 1932 г Дж. Чедвик, проводя опыты по бомбардировке атомов бериллия ᾳ-частицами, получил поток
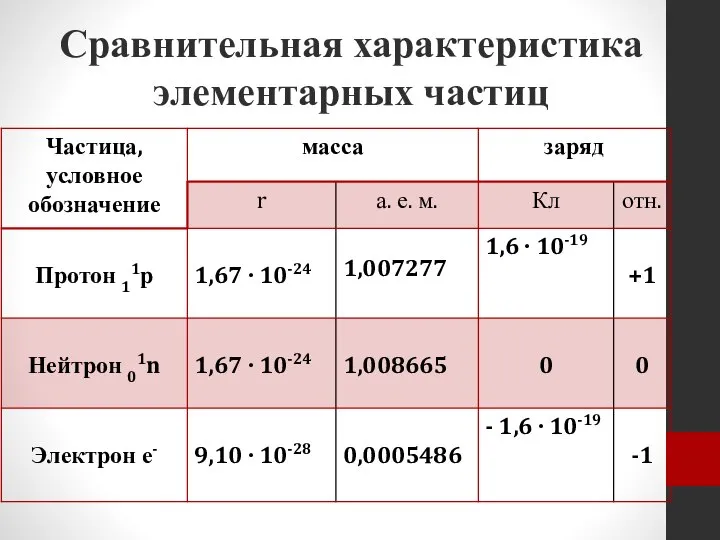
- 13. Сравнительная характеристика элементарных частиц
- 14. МОДЕЛИ СТРОЕНИЯ АТОМА
- 15. Гипотеза Дж. Томсона В 1904 г. в работе «О структуре атома» Томсон дал описание своей модели
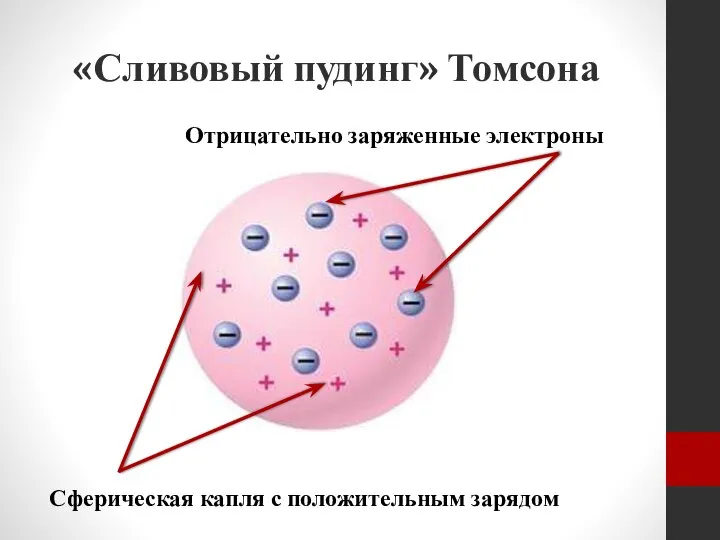
- 16. «Сливовый пудинг» Томсона Сферическая капля с положительным зарядом Отрицательно заряженные электроны
- 17. Планетарная модель Э. Резерфорда (1911 г)
- 18. Квантовые постулаты Н. Бора В 1913 году датский физик Нильс Бор разрешил противоречия, внеся в планетарную
- 19. Квантовые постулаты Н. Бора Электрон вращается вокруг ядра по строго определенным замкнутым стационарным орбитам в соответствии
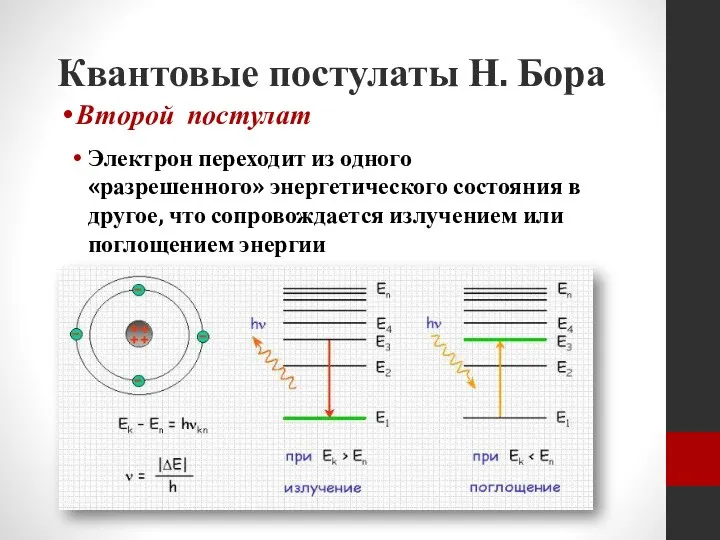
- 20. Квантовые постулаты Н. Бора Электрон переходит из одного «разрешенного» энергетического состояния в другое, что сопровождается излучением
- 21. Корпускулярно-волновой дуализм Объекты микромира являются одновременно и частицами и волной, так как для них характерны явления
- 22. Тест 1. Какие частицы входят в состав ядра атома? 1) Протоны и электроны 2) Электроны, протоны,
- 23. 4. Каковы знаки зарядов протона, нейтрона, электрона? 1) У протона положительный; нейтрон не имеет заряда; у
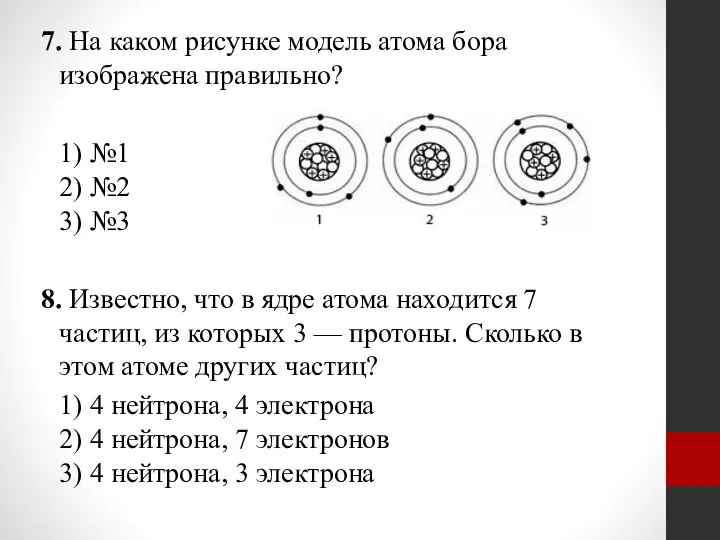
- 24. 7. На каком рисунке модель атома бора изображена правильно? 1) №1 2) №2 3) №3 8.
- 25. 9. Ион — это 1) атом, потерявший один или несколько электронов 2) атом, присоединивший к себе
- 27. Скачать презентацию















 Внутренняя энергия. Работа в термодинамике. Количество теплоты
Внутренняя энергия. Работа в термодинамике. Количество теплоты Механические колебания
Механические колебания Скорость движения 7 класс
Скорость движения 7 класс Магнитное поле и его наибольшая величина
Магнитное поле и его наибольшая величина Изменения геофизических характеристик прискважинной зоны
Изменения геофизических характеристик прискважинной зоны Значение визуальной демонстрации опытов Бернулли
Значение визуальной демонстрации опытов Бернулли Механическая работа. Единицы работы
Механическая работа. Единицы работы Свойства веществ
Свойства веществ Работа газа и пара при расширении. Двигатель внутреннего сгорания
Работа газа и пара при расширении. Двигатель внутреннего сгорания Презентация на тему Основные положения молекулярно-кинетической теории
Презентация на тему Основные положения молекулярно-кинетической теории  Сложение двух сил, направленных по одной прямой. Равнодействующая сила
Сложение двух сил, направленных по одной прямой. Равнодействующая сила Механическая работа
Механическая работа Электромагнетический индукционный генератор-устройство
Электромагнетический индукционный генератор-устройство Навозоудаление
Навозоудаление Физические величины и их измерение. Задания
Физические величины и их измерение. Задания Презентация на тему Ядерная физика (9 класс)
Презентация на тему Ядерная физика (9 класс)  Электрические цепи с распределенными параметрами
Электрические цепи с распределенными параметрами Тема 2. Норм.точности подшипников. соед-й
Тема 2. Норм.точности подшипников. соед-й Бесциркуляционное течение около цилиндра. Лекция 7
Бесциркуляционное течение около цилиндра. Лекция 7 Законы постоянного тока. Лекция 10
Законы постоянного тока. Лекция 10 Физика – наука о природе. 9 класс
Физика – наука о природе. 9 класс Достижения современной физики в нашей жизни. Производные предлоги. Узкоспециальные термины. Глаголы с абстрактным значением
Достижения современной физики в нашей жизни. Производные предлоги. Узкоспециальные термины. Глаголы с абстрактным значением Магниты и их применение
Магниты и их применение Аэродинамика. Лекция 2
Аэродинамика. Лекция 2 Методические указания к курсовому проекту по спецкурсу № 2. Теории ядерных реакторов
Методические указания к курсовому проекту по спецкурсу № 2. Теории ядерных реакторов Теория автоматического управления. Позиционные звенья
Теория автоматического управления. Позиционные звенья Радиоактивные превращения. Экспериментальные методы исследования частиц
Радиоактивные превращения. Экспериментальные методы исследования частиц “Жарық техникасы және жарық көздері” пәні бойынша оқу-әдістемелік кешенін жасақтау
“Жарық техникасы және жарық көздері” пәні бойынша оқу-әдістемелік кешенін жасақтау