Содержание
- 2. Лекция 5 Второй закон термодинамики. Энтропия – функция состояния. Изменение энтропии при необратимых процессах. Производство энтропии.
- 3. Для реакции 3KF(тв.) +AlF3(тв) = K3AlF6(тв) измерили тепловой эффект QV при температуре T. Нужно посчитать энтальпию
- 4. Простым веществом для элемента Pt служит Pt(тв). Какое из следующих утверждений верно? 1 балл
- 5. Мы знаем, что для реакции 3K(тв.) +Al (тв.) + 3F2(газ) = K3AlF6(тв) величина ∆ср положительна. Как
- 6. Первый закон термодинамики. У любой системы существует функция состояния, называемая внутренней энергией, U. Второй закон термодинамики.
- 7. Полный дифференциал внутренней энергии, dU, равен: Закрытая система Система переходит из состояния 1 в состояние 2:
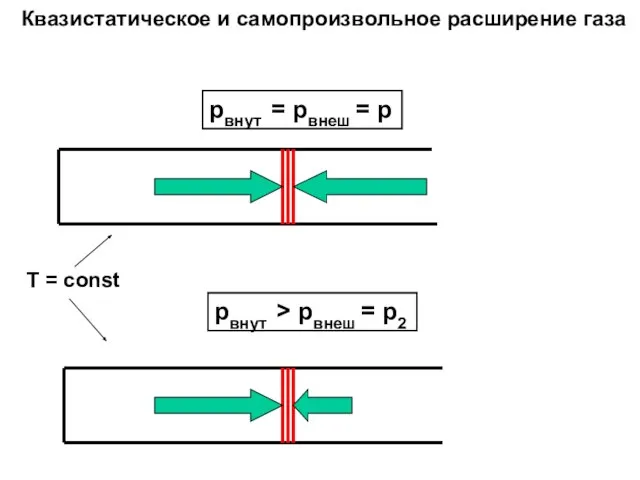
- 8. pвнут = pвнеш = p pвнут > pвнеш = p2 Квазистатическое и самопроизвольное расширение газа T
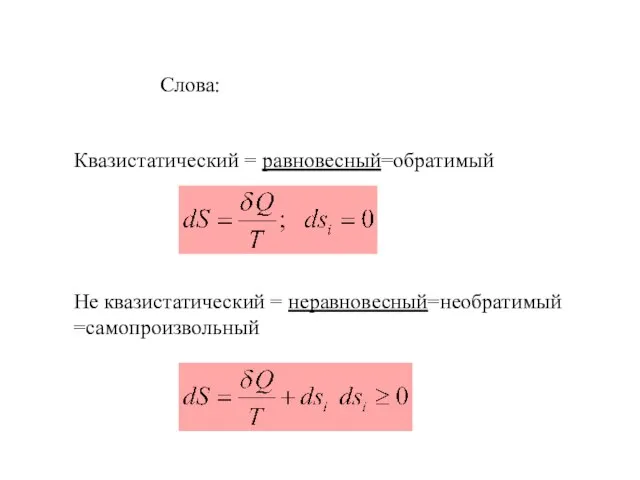
- 9. Слова: Квазистатический = равновесный=обратимый Не квазистатический = неравновесный=необратимый =самопроизвольный
- 10. Состояния равновесия. (Предварительное определение) Это состояния, к которым самопроизвольно стремится всякая система. Система сама не может
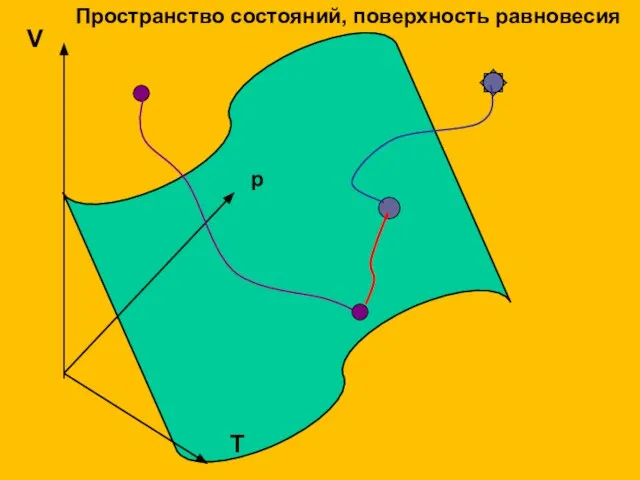
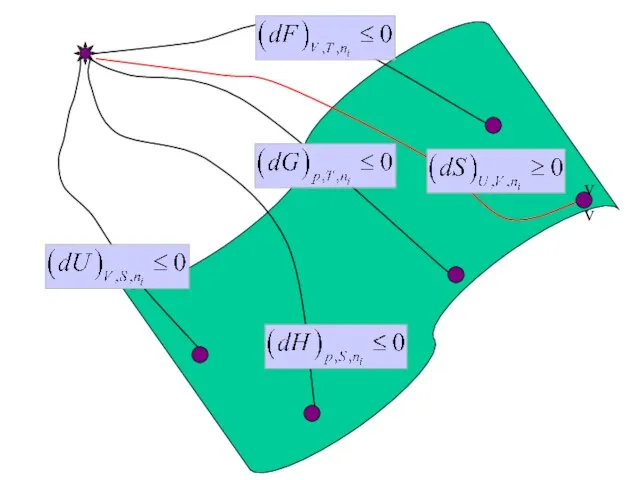
- 11. V p T Пространство состояний, поверхность равновесия
- 12. Выберите правильные утверждения: В любом равновесном процессе энтропия системы не меняется. 2) В любом неравновесном процессе
- 13. Какие из этих формул для энтропии, S, системы - неправильные ? 2 балла
- 14. МАТЕМАТИЧЕСКИЙ АППАРАТ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Фундаментальное уравнение
- 15. ФУНДАМЕНТАЛЬНОЕ УРАВНЕНИЕ (1+2 законы) Равновесный процесс
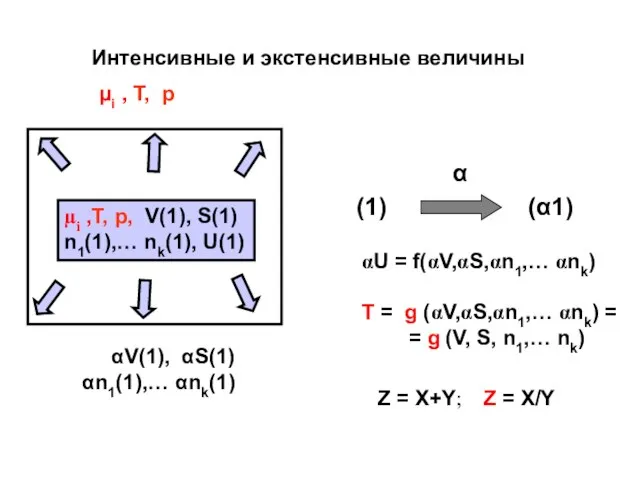
- 16. µi ,T, p, V(1), S(1) n1(1),… nk(1), U(1) µi , T, p αV(1), αS(1) αn1(1),… αnk(1)
- 17. ТЕОРЕМА ЭЙЛЕРА. U – однородная функция V,S,ni U = f (V, S, ni) αU = f
- 18. УРАВНЕНИЕ ГИББСА-ДЮГЕМА.
- 19. МАТЕМАТИЧЕСКИЙ АППАРАТ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Построение характеристических функций
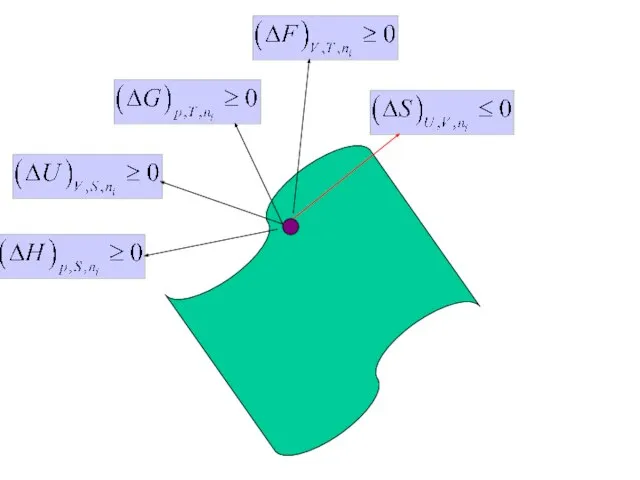
- 20. ФУНДАМЕНТАЛЬНОЕ УРАВНЕНИЕ (1+2 законы) Самопроизвольный процесс
- 21. ФУНДАМЕНТАЛЬНОЕ УРАВНЕНИЕ (1+2 законы)
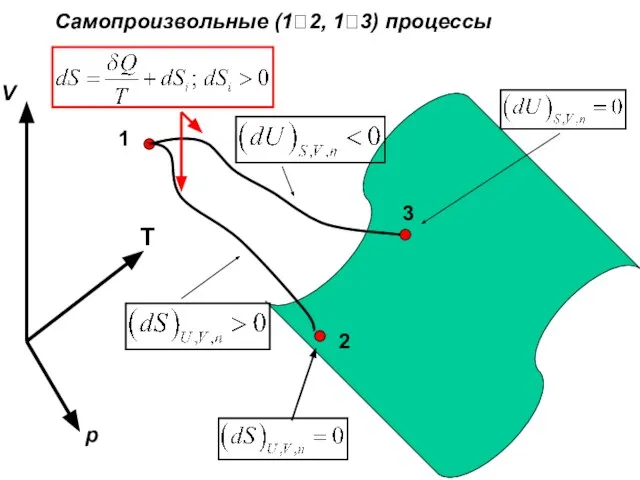
- 22. Самопроизвольные (1?2, 1?3) процессы 1 2 3 V p T
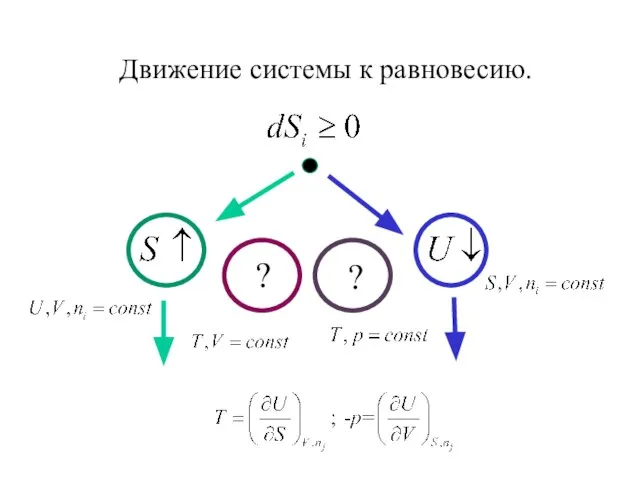
- 23. Движение системы к равновесию. ? ?
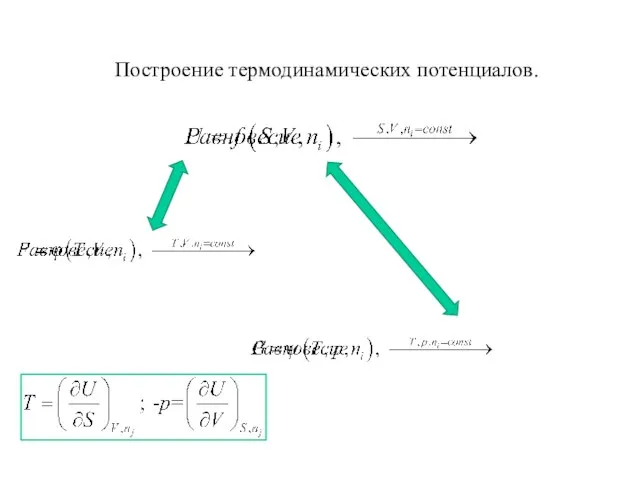
- 24. Построение термодинамических потенциалов.
- 25. Есть функция: Необходимо построить функцию: Рецепт: Проверка: Преобразование Лежандра
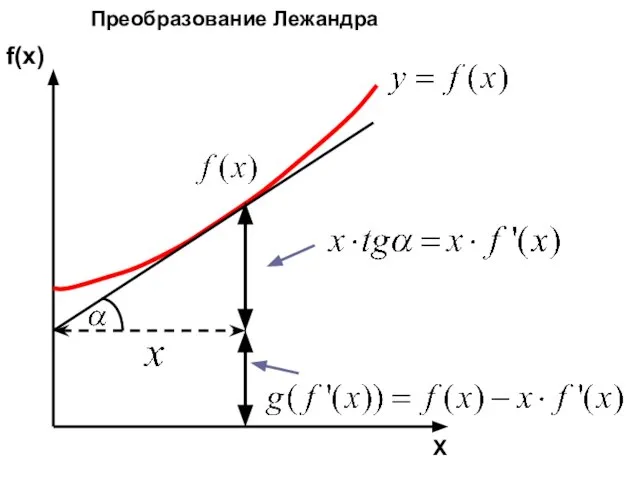
- 26. f(x) X Преобразование Лежандра
- 27. ПРЕОБРАЗОВАНИЕ ЛЕЖАНДРА.
- 28. ПРЕОБРАЗОВАНИЕ ЛЕЖАНДРА.
- 29. ПРЕОБРАЗОВАНИЕ ЛЕЖАНДРА.
- 30. Как работает энергия Гиббса, G = U-TS+pV ? Самопроизвольный процесс Равновесный процесс
- 31. Как работают характеристические функции?
- 32. vv
- 34. МАТЕМАТИЧЕСКИЙ АППАРАТ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Соотношения Максвелла
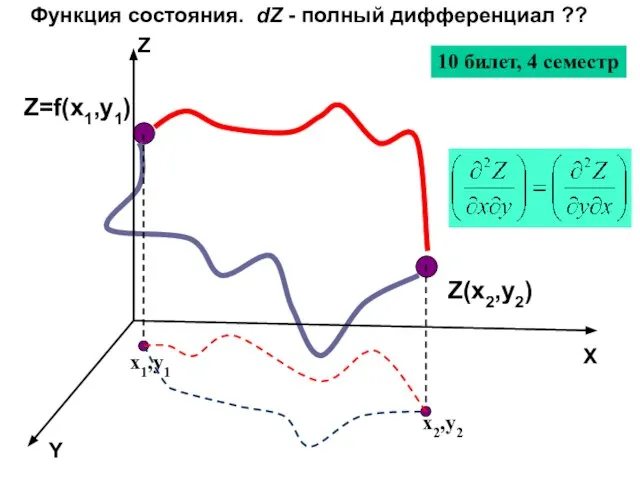
- 35. Z=f(x1,y1) Z(x2,y2) Функция состояния. dZ - полный дифференциал ?? Z Y X x1,y1 x2,y2 10 билет,
- 36. Соотношения Максвелла
- 37. Внутренняя энергия идеального газа при T =const не зависит от объема? Используем соотношение Максвелла !
- 38. Энтальпия идеального газа при T=const не зависит от давления? Используем соотношение Максвелла !
- 39. ХИМИЧЕСКИЙ ПОТЕНЦИАЛ, μi
- 40. Определения химического потенциала
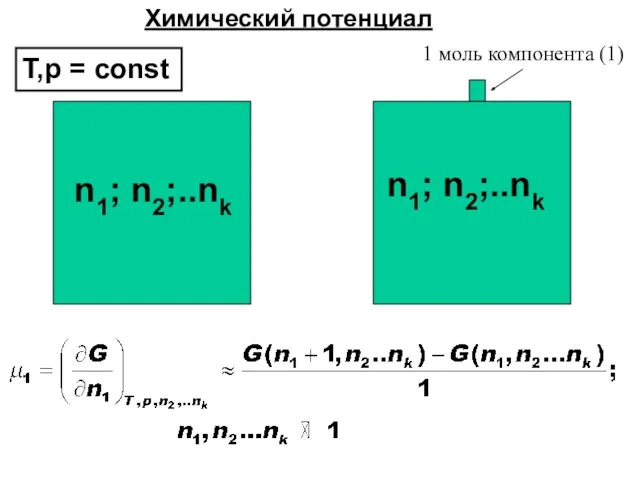
- 41. n1; n2;..nk n1; n2;..nk 1 моль компонента (1) Химический потенциал T,p = const
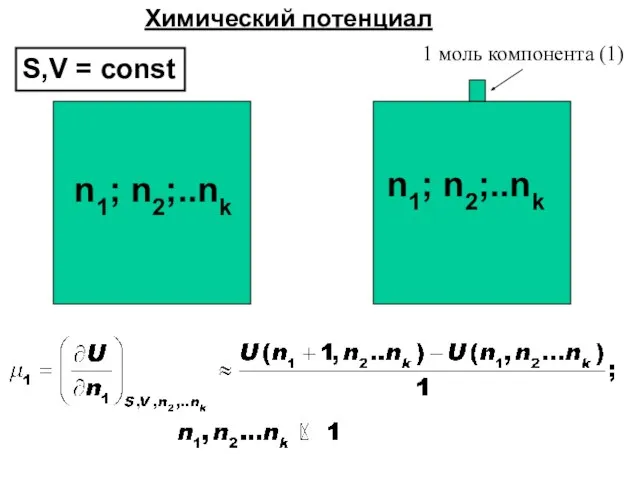
- 42. n1; n2;..nk n1; n2;..nk 1 моль компонента (1) Химический потенциал S,V = const
- 43. Химический потенциал
- 44. Химический потенциал идеального газа
- 45. Химический потенциал реального газа
- 47. Скачать презентацию































 Ядерные силы. Ядерные реакции
Ядерные силы. Ядерные реакции Радиоактивные изотопы в биологии и медицине, археологии
Радиоактивные изотопы в биологии и медицине, археологии SVC Bulletin. Замена компрессора FMC088NAMA на FMA102NAMA
SVC Bulletin. Замена компрессора FMC088NAMA на FMA102NAMA Защитный фартук
Защитный фартук Законы Ньютона. Закон всемирного тяготения. Сила тяжести. Космические скорости
Законы Ньютона. Закон всемирного тяготения. Сила тяжести. Космические скорости Простые механизмы
Простые механизмы Импульс тела. Закон сохранения импульса
Импульс тела. Закон сохранения импульса Постоянный ток ЭДС и внутреннее сопротивление источника тока. 10 класс
Постоянный ток ЭДС и внутреннее сопротивление источника тока. 10 класс Магнитное поле. Электромагнитная индукция. Подготовка к контрольной работе
Магнитное поле. Электромагнитная индукция. Подготовка к контрольной работе Интерференция света. Электромагнитная природа света
Интерференция света. Электромагнитная природа света Четыре вида взаимодействий в физике
Четыре вида взаимодействий в физике Работа с lego mindstorms ev3. Задание № 1: движение вперед и назад
Работа с lego mindstorms ev3. Задание № 1: движение вперед и назад Простые механизмы
Простые механизмы Предмет физики. Основные этапы истории физики
Предмет физики. Основные этапы истории физики Визуализация 3М сцен
Визуализация 3М сцен Вихревые индукционные нагреватели
Вихревые индукционные нагреватели Вес тела. Невесомость
Вес тела. Невесомость Свойства жидкостей. Поверхностное натяжение
Свойства жидкостей. Поверхностное натяжение Оптические явления в природе
Оптические явления в природе Униполярные двигатели
Униполярные двигатели Элементы специальной теории относительности (СТО). Лекция 7
Элементы специальной теории относительности (СТО). Лекция 7 Электромагнитное поле. Викторина
Электромагнитное поле. Викторина Леонардо да Винчи, его вклад в развитие механики
Леонардо да Винчи, его вклад в развитие механики Зрение домашних животных
Зрение домашних животных Магнитное поле электрического тока
Магнитное поле электрического тока Сила упругости. Закон Гука. Жесткость
Сила упругости. Закон Гука. Жесткость Изменения числа электронов на внешнем уровне атома – образование ионов
Изменения числа электронов на внешнем уровне атома – образование ионов Аэродинамика Т 5-1
Аэродинамика Т 5-1