Содержание
- 2. Общие положения Молекулярная физика—раздел физики, в котором изучаются строение и свойства вещества исходя из молекулярно-кинетических представлений,
- 3. Общие положения В основе молекулярно-кинетической теории лежат три положения: 1. Все вещества – жидкие, твердые и
- 4. Общие характеристики атомов и молекул Размеры молекулы где V- объем, взятого вещества; S – площадь, занимаемая
- 5. Общие характеристики атомов и молекул 2. Относительная молекулярная масса (Мr) вещества– отношение массы молекулы этого вещества
- 6. Общие характеристики атомов и молекул 4. Молярная масса (М) – масса одного моля. М измеряется в
- 7. Общие характеристики атомов и молекул Число молей, содержащихся в массе m вещества, определяется формулой: 5) Число
- 8. Параметры состояния Для описания поведения макросистем вводят физические величины, которые называют параметрами состояния системы. Основными параметрами
- 9. Параметры состояния В технике широко используется внесистемная единица измерения давления– техническая атмосфера(ат): 1 ат= 98066,5 Па
- 10. Параметры состояния Объем – область пространства, занимаемая системой. Удельный объем v—это объем единицы массы. Когда тело
- 11. Параметры состояния Понятие температуры имеет смысл для равновесных состояний системы. Равновесным состоянием называется состояние системы, не
- 12. Параметры состояния Абсолютная температура Т и температура t по стоградусной шкале связаны соотношением: Температура Т =
- 13. В молекулярно-кинетической теории пользуются идеализированной моделью идеального газа, согласно которой считают, что: 1)собственный объем молекул газа
- 14. Законы идеальных газов Рассмотрим законы, описывающие поведение идеальных газов. В XVII – XIX веках были сформулированы
- 15. Законы идеальных газов Уравнение изохоры: Если температура газа выражена в градусах Цельсия, то уравнение изохорического процесса
- 16. Законы идеальных газов 2. Изобарический процесс. Закон Гей-Люссака. Р = const. Изобарическим процессом называется процесс, протекающий
- 17. Законы идеальных газов График такой зависимости имеет вид
- 18. Законы идеальных газов 3. Изотермический процесс. Закон Бойля – Мариотта. T = const. Изотермическим процессом называется
- 19. Законы идеальных газов 4) Адиабатический процесс – процесс, протекающий без теплообмена с окружающей средой, т.е. при
- 20. Законы идеальных газов 6)Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений p1, р2..., рn
- 21. Уравнение Клапейрона– Менделеева Состояние некоторой массы газа определяется тремя термодинамиче-скими параметрами: давлением р, объемом V и
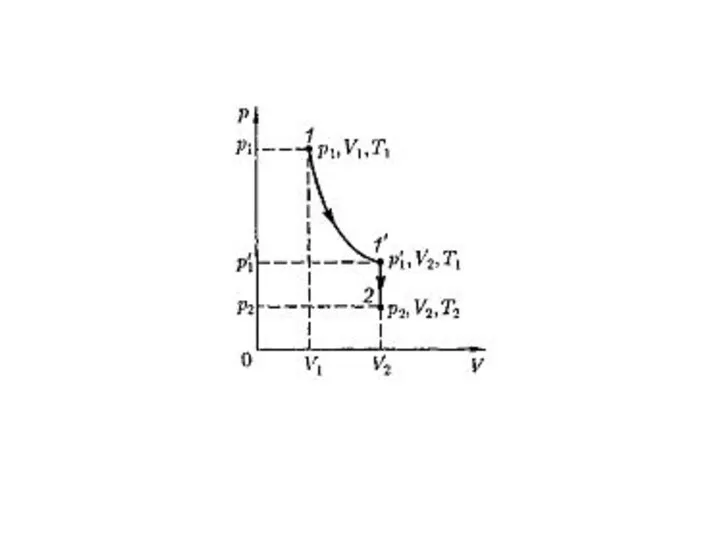
- 23. Уравнение Клапейрона– Менделеева В соответствии с законами Бойля– Мариотта и Гей-Люссака запишем: Исключив из уравнений р'1,
- 24. Уравнение Клапейрона– Менделеева Эта общая для всех газов постоянная обозначается R и называется молярной газовой постоянной.
- 25. Уравнение Клапейрона– Менделеева Уравнение Клапейрона– Менделеева для массы m газа где v = m/M – количество
- 26. Основное уравнение молекулярно-кинетической теории газов Основное уравнение молекулярно-кинетической теории газов связывает макроскопический параметр системы– давление, с
- 27. Основное уравнение молекулярно-кинетической теории газов Величина средней кинетической энергии теплового движения одной молекулы определяется С учетом
- 28. Распределение Максвелла При столкновении молекулы газа изменяют свои скорости. Изменение скорости молекул происходит случайным образом. Нельзя
- 29. Распределение Максвелла Отношение дает вероятность того, что скорость молекулы будет иметь значение в пределах данного интервала
- 30. Распределение Максвелла Функция распределения была найдена теоретически Максвеллом. Она имеет следующий вид и называется функцией распределения
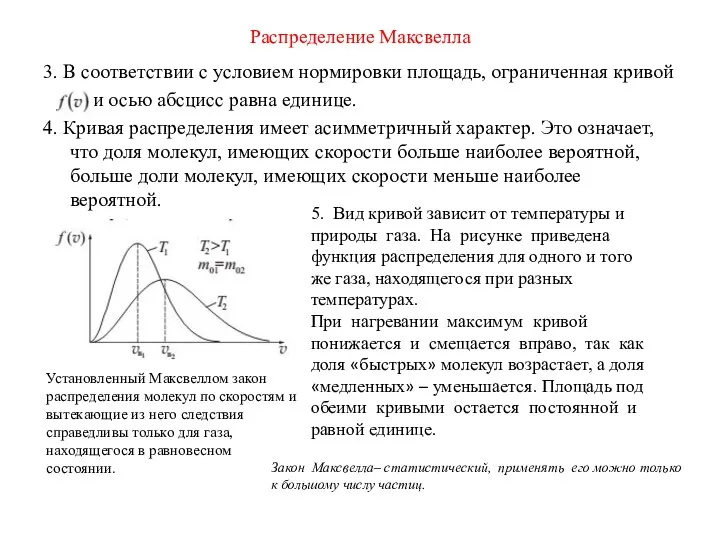
- 31. Распределение Максвелла Проведем анализ графика. 1. При скоростях стремящихся к нулю(v→0) и к бесконечности(v→ ∞) функция
- 32. Распределение Максвелла 3. В соответствии с условием нормировки площадь, ограниченная кривой и осью абсцисс равна единице.
- 33. Средние скорости Пользуясь функцией распределения Максвелла f(v ), можно найти ряд средних величин, характеризующих состояние молекул.
- 34. Средние скорости Если учесть, что масса одной молекулы равна где М– молярная масса; NA– число Авогадро,
- 35. Идеальный газ в однородном поле тяготения Молекулы любого газа всегда находятся в поле тяготения Земли. На
- 36. Барометрическая формула Закон изменения давления p идеального газа с высотой h в однородном поле тяготения описывается
- 37. Барометрическая формула На рисунке представлены две кривые, описанные уравнением Лапласа. Их можно рассматривать, как соответствующие разным
- 38. Барометрическая формула
- 39. Распределение Больцмана
- 40. Распределение Больцмана Из анализа полученной формулы можно сделать следующие выводы. 1. С понижением температуры концентрация молекул
- 42. Скачать презентацию





































 Электрическое сопротивление. Удельное сопротивление
Электрическое сопротивление. Удельное сопротивление Эвольвента. Лекции 9
Эвольвента. Лекции 9 Параметры и виды передающих оптических модулей
Параметры и виды передающих оптических модулей Ультразвуковой контроль (УЗК). Методы и оборудование УЗД
Ультразвуковой контроль (УЗК). Методы и оборудование УЗД Механическое движение
Механическое движение Испарение. Насыщенный пар и его свойства. Влажность воздуха
Испарение. Насыщенный пар и его свойства. Влажность воздуха Теоретическая механика модуль 1. Раздел 2 – кинематика
Теоретическая механика модуль 1. Раздел 2 – кинематика Преобразования сигналов и Вейвлет-преобразование
Преобразования сигналов и Вейвлет-преобразование Ядерные силы. Дефект масс. Энергия связи
Ядерные силы. Дефект масс. Энергия связи Professional english for mechanics
Professional english for mechanics Развитие познавательного интереса к предмету физика
Развитие познавательного интереса к предмету физика Показатели надежности электроснабжения
Показатели надежности электроснабжения Оборудование для переработки каучука
Оборудование для переработки каучука Kinematika_tverdogo_tela_33__33__33
Kinematika_tverdogo_tela_33__33__33 Характеристика волн. Величины, характеризующие волну
Характеристика волн. Величины, характеризующие волну Методика организации и проведения лабораторного практикума по физике в современной школе
Методика организации и проведения лабораторного практикума по физике в современной школе Электрические цепи
Электрические цепи lek2 _кинем
lek2 _кинем Нелинейные СКВИД метаматериалы
Нелинейные СКВИД метаматериалы Строения атомов
Строения атомов Стенд для лабораторных работ Зубчатые передачи
Стенд для лабораторных работ Зубчатые передачи Какие бывают машины
Какие бывают машины Тепловые двигатели
Тепловые двигатели Игра для семиклассников Физика и мы
Игра для семиклассников Физика и мы Буровые машины для открытых горных пород. Лекция 8
Буровые машины для открытых горных пород. Лекция 8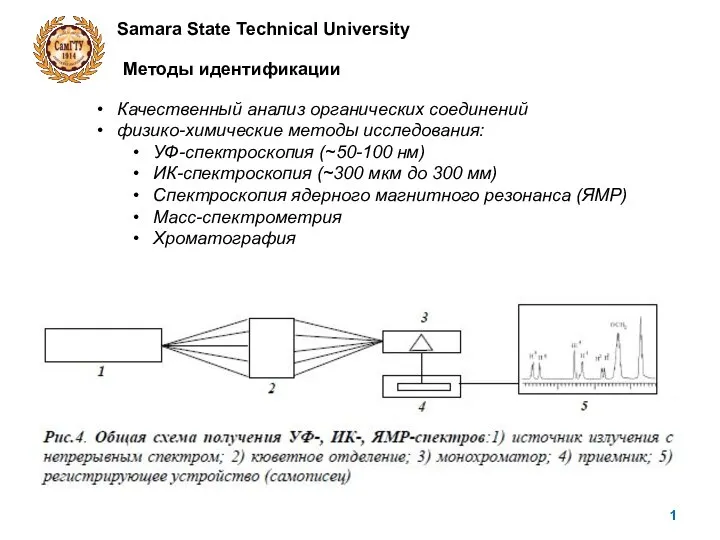 масс-1
масс-1 Высота. Тембр и громкость звука
Высота. Тембр и громкость звука Touareg CR. Замена шаровой несущего рычага на автомобиле с пневмоподвеской
Touareg CR. Замена шаровой несущего рычага на автомобиле с пневмоподвеской