Слайд 2Обычно решение этих задач не представляет особых сложностей, однако часто выпускники теряют

баллы на этой задаче.
Слайд 3
Причин бывает несколько:
Некорректное оформление;
Решение не математическим путем, а методом перебора;
Неверно составленная общая

формула вещества;
Ошибки в уравнении реакции с участием вещества, записанного в общем виде.
Слайд 4Типы задач в задании С5.
Задачи на определение формулы органического вещества бывают

нескольких видов:
Определение формулы вещества по массовым долям химических элементов или по общей формуле вещества;
Определение формулы вещества по продуктам сгорания;
Определение формулы вещества по химическим свойствам.
Слайд 5Необходимые теоретические сведения

Слайд 6План
Массовая доля элемента в веществе
Молекулярная и простейшая формула вещества
Относительная плотность газа Х

по газу У — DпоУ(Х)
Абсолютная плотность газа при нормальных условиях
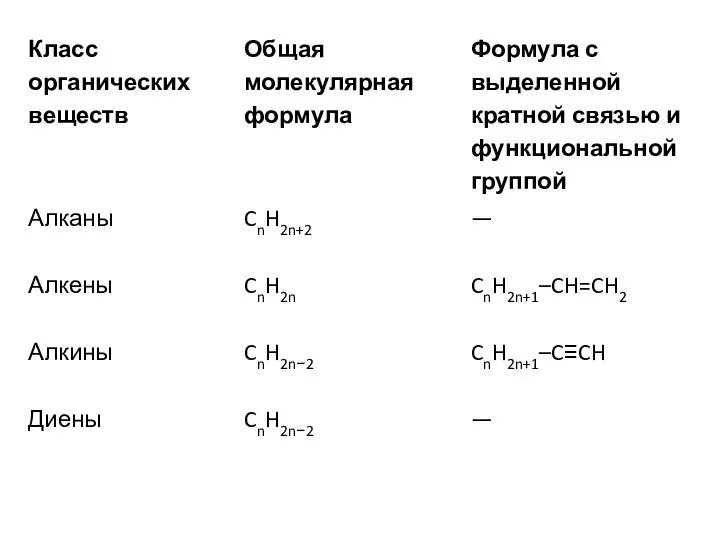
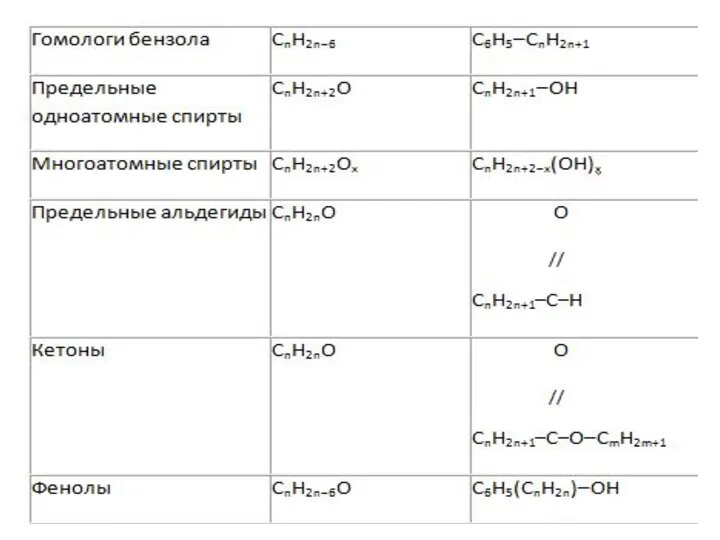
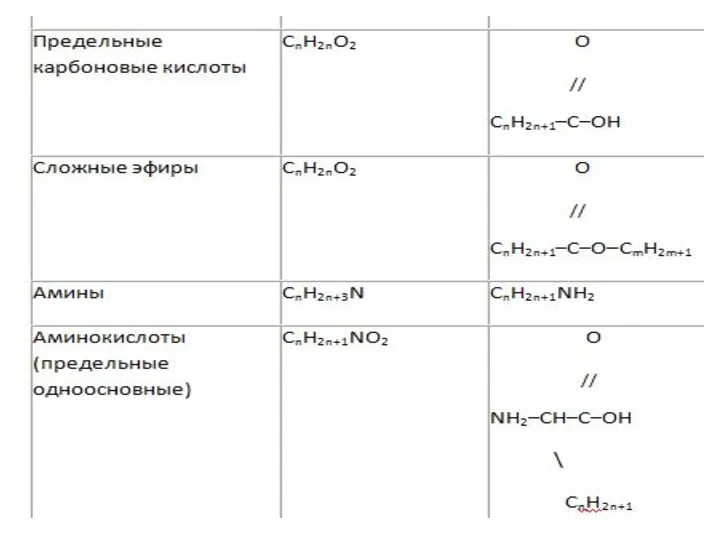
Общие формулы веществ разных классов
Слайд 7
1) Массовая доля элемента в веществе
Массовая доля элемента — это его содержание

в веществе в процентах по массе.
Слайд 8Например, в веществе состава С2Н4 содержится 2 атома углерода и 4 атома водорода.
Если

взять 1 молекулу такого вещества, то его молекулярная масса будет равна:
Мr(С2Н4) = 2 • 12 + 4 • 1 = 28 а.е.м. и там содержится 2 • 12 а.е.м. углерода.
Чтобы найти массовую долю углерода в этом веществе, надо его массу разделить на массу всего вещества:
ω(C) = 12 • 2 / 28 = 0,857 или 85,7%.
Слайд 9 Если вещество имеет общую формулу СхНуОz, то массовые доли каждого их

атомов так же равны отношению их массы к массе всего вещества.
Масса х атомов С равна — 12х, масса у атомов Н — у, масса z атомов кислорода — 16z.
Тогда
ω(C) = 12 • х / (12х + у + 16z)
Слайд 10
Если записать эту формулу в общем виде, то получится следующее выражение:
Массовая доля

атома Э в веществе =
Аr(Э) • z
——————
Mr(вещ.)
Mr(вещ.) - Молекулярная масса вещества
Аr(Э) -Атомная масса атома Э
z - число атомов Э в молекуле
Слайд 11
2) Молекулярная и простейшая формула вещества
Молекулярная (истинная) формула — формула, в которой

отражается реальное число атомов каждого вида, входящих в молекулу вещества.
Например, С6Н6 — истинная формула бензола.
Простейшая (эмпирическая) формула — показывает соотношение атомов в веществе.
Например, для бензола соотношение С:Н = 1:1, т.е. простейшая формула бензола — СН.
Молекулярная формула может совпадать с простейшей или быть кратной ей.
Слайд 13Если в задаче даны только массовые доли элементов, то в процессе решения

задачи можно вычислить только простейшую формулу вещества.
Для получения истинной формулы в задаче обычно даются дополнительные данные — молярная масса, относительная или абсолютная плотность вещества или другие данные, с помощью которых можно определить молярную массу вещества.
Слайд 143) Относительная плотность газа Х по газу У — DпоУ(Х).
Относительная плотность

D — это величина, которая показывает, во сколько раз газ Х тяжелее газа У.
Её рассчитывают как отношение молярных масс газов Х и У:
DпоУ(Х) = М(Х) / М(У)
Слайд 15Часто для расчетов используют относительные плотности газов по водороду и по воздуху.
Относительная

плотность газа Х по водороду:
Dпо H2 = M(газа Х) / M(H2) = M(газа Х) / 2
Слайд 16Относительная плотность газов по по воздуху
Воздух — это смесь газов, поэтому для

него можно рассчитать только среднюю молярную массу.
Её величина принята за 29 г/моль (исходя из примерного усреднённого состава).
Поэтому:
Dпо возд. = М(газа Х) / 29
Слайд 17
4) Абсолютная плотность газа при нормальных условиях
Абсолютная плотность газа — это масса

1 л газа при нормальных условиях.
Обычно для газов её измеряют в г/л.
ρ = m(газа) / V(газа)
Если взять 1 моль газа, то тогда:
ρ = М / Vm,
а молярную массу газа можно найти, умножая плотность на молярный объём.
Слайд 18
5)Общие формулы веществ разных классов
Часто для решения задач с химическими реакциями удобно

пользоваться не обычной общей формулой, а формулой, в которой выделена отдельно кратная связь или функциональная группа.
Слайд 22Источники
http://ege-study.ru/materialy-ege/ximiya-chast-s-zadacha-s5-opredelenie-formul-organicheskix-veshhestv/



















 Электрический ток
Электрический ток Маятниковые копры
Маятниковые копры Link Stabilizer maintenance judjement standart
Link Stabilizer maintenance judjement standart Закон сохранения импульса
Закон сохранения импульса Сложение сил
Сложение сил Роль русских ученых в развитии электротехники
Роль русских ученых в развитии электротехники Расчет износа деталей транспортных средств
Расчет износа деталей транспортных средств Исследование схемы измерения сопротивления заземлителя МС-08
Исследование схемы измерения сопротивления заземлителя МС-08 Методика определения среднего размера ансамбля нанокластеров на поверхности подложки при помощи методов РФЭС, ОЭС, ОРР
Методика определения среднего размера ансамбля нанокластеров на поверхности подложки при помощи методов РФЭС, ОЭС, ОРР Презентация на тему Оптические приборы (11 класс)
Презентация на тему Оптические приборы (11 класс)  Назначение и устройство шатунов, шатунных подшипников и поршней дизелей. Порядок расположения кривошипов валов
Назначение и устройство шатунов, шатунных подшипников и поршней дизелей. Порядок расположения кривошипов валов Транспортные, транспортирующие и погрузочно-разгрузочные машины. Тема 2
Транспортные, транспортирующие и погрузочно-разгрузочные машины. Тема 2 3_ЭМКолебания
3_ЭМКолебания Электрический заряд, электризация
Электрический заряд, электризация Кең ауқымды вибратор
Кең ауқымды вибратор Сопротивление материалов. Построение эпюр внутренних силовых факторов в кривом брусе
Сопротивление материалов. Построение эпюр внутренних силовых факторов в кривом брусе Законы Ньютона (10 класс)
Законы Ньютона (10 класс) Презентация на тему Постоянные магниты. Магнитное поле Земли
Презентация на тему Постоянные магниты. Магнитное поле Земли  Расчёт сопротивления электрических цепей
Расчёт сопротивления электрических цепей Магнитное поле
Магнитное поле Нагревание проводников электрическим током. Закон Джоуля-Ленца
Нагревание проводников электрическим током. Закон Джоуля-Ленца Сила упругости
Сила упругости Релятивистская динамика
Релятивистская динамика Формообразование на станках
Формообразование на станках Презентация на тему Зрение
Презентация на тему Зрение  Внутренняя энергия
Внутренняя энергия Презентация на тему Викторина по физике
Презентация на тему Викторина по физике  Презентация на тему Явление электромагнитной индукции
Презентация на тему Явление электромагнитной индукции