Содержание
- 2. Молекулярно-кинетическая теория Характерные размеры молекул: 2·10-10-2·10-9 м В 1 см3 воздуха, к примеру, содержится 2.7·1019 молекул
- 3. Молекулярно-кинетическая теория Число молекул в 0.012 кг углерода называется постоянной Авогадро или числом Авогадро Na Na=6,02·1023
- 4. Молекулярно-кинетическая теория Количеством вещества ν называют отношение числа молекул N в данном теле к числу молекул
- 5. Молекулярно-кинетическая теория Зная количество вещества и постоянную Авогадро, можно определить число молекул в теле:
- 6. Молекулярно-кинетическая теория Зная количество вещества и постоянную Авогадро, можно определить число молекул в теле:
- 7. Молекулярно-кинетическая теория Зная количество вещества и постоянную Авогадро, можно определить число молекул в теле: Молярной массой
- 8. Молекулярно-кинетическая теория Для определения массы молекулы необходимо молярную массу разделить на постоянную Авогадро: Масса m любого
- 9. Молекулярно-кинетическая теория Для определения массы молекулы необходимо молярную массу разделить на постоянную Авогадро: Масса m любого
- 10. Молекулярно-кинетическая теория Для определения массы молекулы необходимо молярную массу разделить на постоянную Авогадро: Масса m любого
- 11. Молекулярно-кинетическая теория Отсюда следует соотношение: Используя это соотношение, можно дать еще одно определение количества вещества: Количество
- 12. Газообразное состояние вещества Газообразное состояние – весьма распространенное состояние вещества во Вселенной. Встречающиеся в природе газы
- 13. Газообразное состояние вещества Газы не имеют постоянного объема Газы не имеют собственной формы Газы целиком занимают
- 14. Газообразное состояние вещества Молекулярно-кинетическая теория позволяет установить количественную связь между макроскопическими величинами, характеризующими газ (давление, объем,
- 15. Газообразное состояние вещества Идеальный газ – это модель газа, в которой пренебрегают взаимодействием молекул друг с
- 16. Изотермический процесс Свойства газа зависят от таких его параметров, как давление P, температура t, объем V.
- 17. Изотермический процесс Процесс изменения состояния газа, происходящий при постоянной температуре, называют изотермическим процессом. Закон Бойля-Мариотта: При
- 18. Изобарный процесс Процесс изменения состояния газа, происходящий при постоянном давлении, называется изобарным процессом. Закон Гей-Люссака: При
- 19. Изобарный процесс
- 20. Изохорный процесс Процесс изменения состояния газа, происходящий при постоянном объеме, называется изохорным процессом. Закон Шарля: При
- 22. Скачать презентацию



















 Прогнозирование изменения прочностных свойств резины при ее термическом старении
Прогнозирование изменения прочностных свойств резины при ее термическом старении Закон Джоуля-Ленца. Решение задач
Закон Джоуля-Ленца. Решение задач Виды теплопередачи
Виды теплопередачи Вещества. Науки о природе
Вещества. Науки о природе Изучение тепловых явлений
Изучение тепловых явлений Презентация на тему Закон всемирного тяготения
Презентация на тему Закон всемирного тяготения  Методы обработки экспериментальных данных. Обработка результатов косвенных измерений
Методы обработки экспериментальных данных. Обработка результатов косвенных измерений Коэфициент полезного действия
Коэфициент полезного действия Условие равновесия рычага
Условие равновесия рычага Механические колебания
Механические колебания Виды теплопередачи
Виды теплопередачи Основы термодинамики
Основы термодинамики Théorèmes généraux
Théorèmes généraux Транспортная задача для маршрутизации перевозок
Транспортная задача для маршрутизации перевозок Сила тока. Единицы силы тока. Амперметр
Сила тока. Единицы силы тока. Амперметр Магнитное поле прямого тока и катушки с током
Магнитное поле прямого тока и катушки с током Радиоволны. Свойства
Радиоволны. Свойства Цепи синусоидального тока. Лекция 6
Цепи синусоидального тока. Лекция 6 Спектр электромагнитных волн
Спектр электромагнитных волн Оценка параметров движения при зондировании последовательностью оптических импульсов
Оценка параметров движения при зондировании последовательностью оптических импульсов Удельное электрическое сопротивление горных пород со сложной структурой пористого пространства
Удельное электрическое сопротивление горных пород со сложной структурой пористого пространства Скорость. Равномерное и неравномерное движение
Скорость. Равномерное и неравномерное движение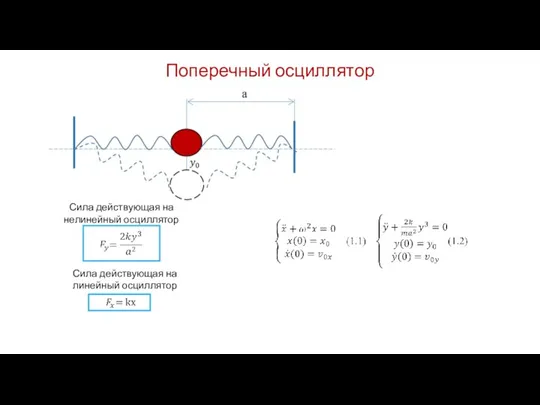 Поперечный осциллятор
Поперечный осциллятор Основные Законы Природы
Основные Законы Природы КПД механизма
КПД механизма Силы в природе Выполнил ученик 7 «А» класса Лабутин Никита, руководитель учитель физики Братушка А.Д.
Силы в природе Выполнил ученик 7 «А» класса Лабутин Никита, руководитель учитель физики Братушка А.Д. Строение вещества
Строение вещества Фазовые диаграммы состояния вещества
Фазовые диаграммы состояния вещества