Слайд 3Всё началось с Гаммета
Луис Плак Гаммет (1894-1987) – крупнейший
американсткий химик. Выпускник

Гарвардского университета.
С 1923 по 1961г. преподавал в Колумбийском университете.
Л.Гаммет считается основателем физической органической
химии. Разработал специальный подход к описанию скоростей
кислотнокатализируемых реакций (функция кислотности
Гаммета), разработал методы оценки эффектов заместителей
(константы заместителей Гаммета), ввел уравнение,
связывающее эффекты заместителей с константами скоростей и
равновесия реакций (уравнение Гаммета).
Автор монографии
«Основы физической органической химии» (М.: Мир, 1972),
которую называют «библией для думающих химиков-
органиков».
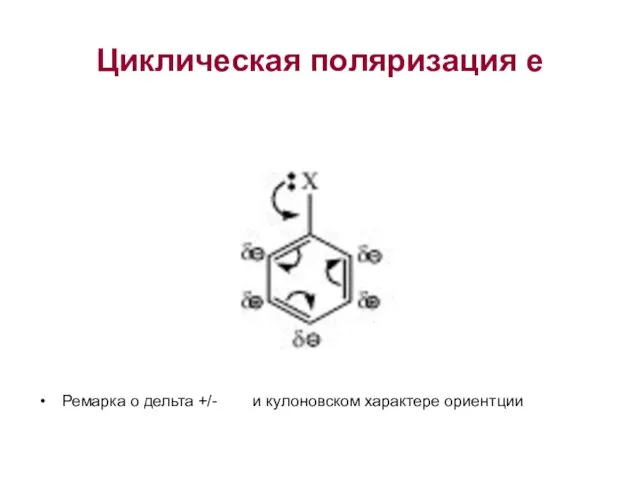
Слайд 4Циклическая поляризация е
Ремарка о дельта +/- и кулоновском характере ориентции
Слайд 6Иллюзии в оргхимии
Представления о циклической поляризации бензольного ядра заместителей различной природы позволяют

согласовать многие экспериментальные данные с электронной природой заместителей.
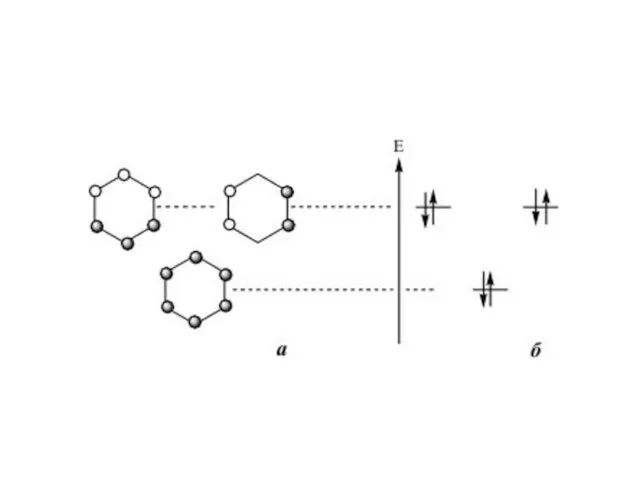
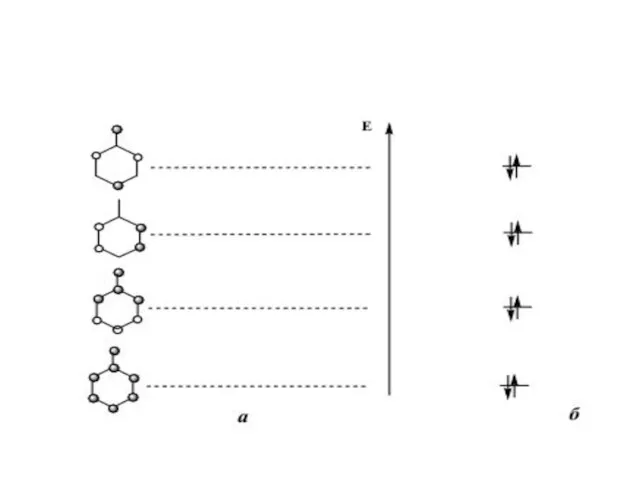
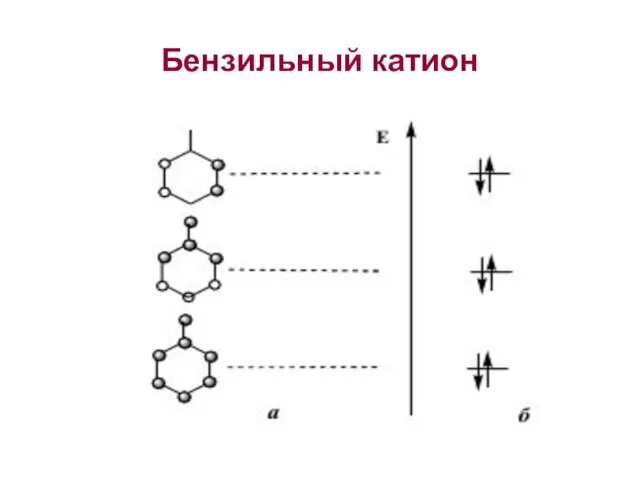
Тем не менее они являются не более чем иллюзией. Истинной причиной появления неравномерного распределения электронной плотности в бензольном ядре при введении в него заместителей является формирование новых молекулярных орбиталей, которое и влечет за собой изменение зарядов на атомах углерода.
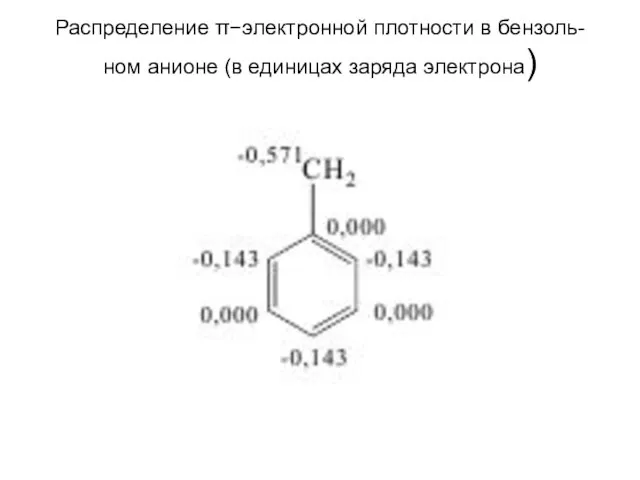
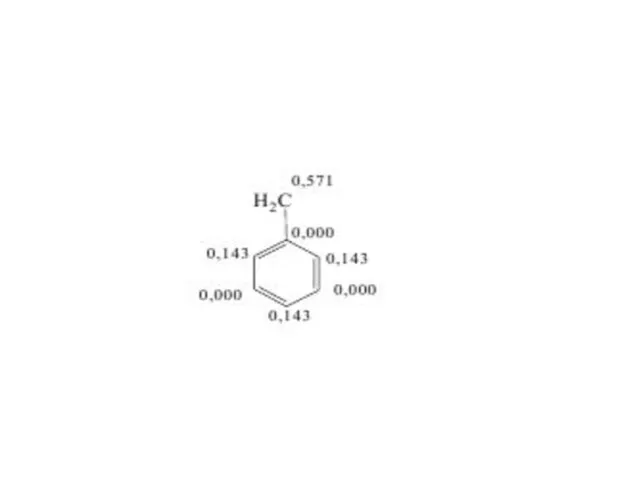
Слайд 9
Распределение π−электронной плотности в бензоль-
ном анионе (в единицах заряда электрона)
Слайд 10Распределение электронной плотности (в единицах
заряда электрона) в молекуле анилина, полученное при
использовании: а
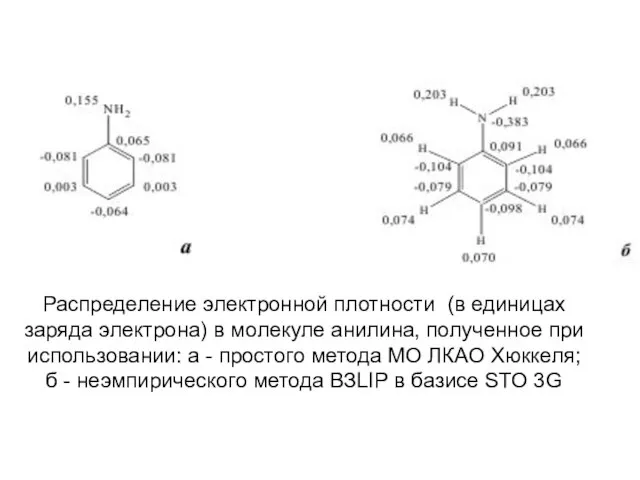
- простого метода МО ЛКАО Хюккеля;
б - неэмпирического метода ВЗLIP в базисе STO 3G
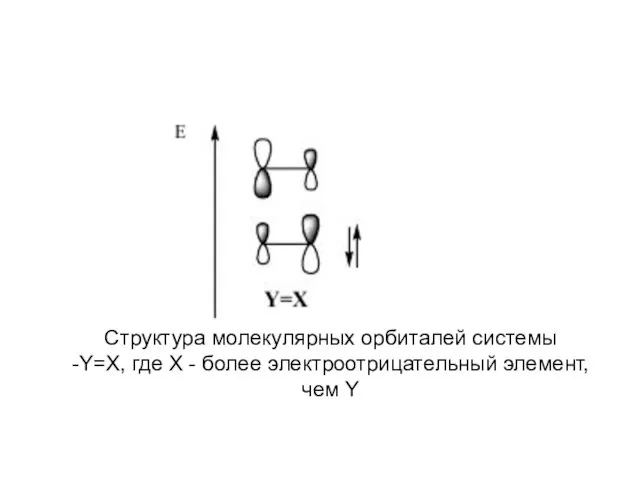
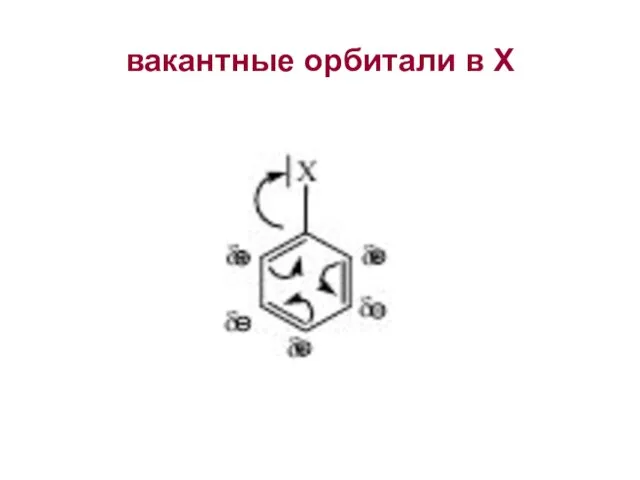
Слайд 13Структура молекулярных орбиталей системы
-Y=X, где Х - более электроотрицательный элемент,
чем Y







 Нанотехнологии и наноматериалы
Нанотехнологии и наноматериалы Презентация на тему Что изучает физика?
Презентация на тему Что изучает физика?  Движение материальной точки. Задачи
Движение материальной точки. Задачи Деление атомного ядра
Деление атомного ядра Условия плавания тел
Условия плавания тел Электростатическое поле в вакууме
Электростатическое поле в вакууме Механические свойства твердых тел
Механические свойства твердых тел Неделя нанотехнологий
Неделя нанотехнологий Радиоволны. Свойства
Радиоволны. Свойства Теплоносители и их свойства. Техническая термодинамика. (Тема 1)
Теплоносители и их свойства. Техническая термодинамика. (Тема 1) Физические величины и их измерение
Физические величины и их измерение Температура плавления нанокластеров. Методика определения фактора Дебая-Валлера по интенсивности спектров СРЭО
Температура плавления нанокластеров. Методика определения фактора Дебая-Валлера по интенсивности спектров СРЭО рух по колу
рух по колу Изменение агрегатного состояния вещества
Изменение агрегатного состояния вещества Магнитное поле Земли
Магнитное поле Земли Материалы для электротехники. Полупроводники
Материалы для электротехники. Полупроводники Динамика точки. Лекция 4
Динамика точки. Лекция 4 Лекция 24. Механическое аккумулирование (гидроаккумулирующая электростанция)
Лекция 24. Механическое аккумулирование (гидроаккумулирующая электростанция) Способы увеличения и уменьшения давления
Способы увеличения и уменьшения давления Стационарное электрическое поле
Стационарное электрическое поле Линейные электрические цепи при гармоническом воздействии
Линейные электрические цепи при гармоническом воздействии Колебания и волны. Волновая оптика
Колебания и волны. Волновая оптика Презентация на тему Магнитное поле и его графическое изображение
Презентация на тему Магнитное поле и его графическое изображение  Проектирование и использование индивидуальных образовательных маршрутов на уроках физики
Проектирование и использование индивидуальных образовательных маршрутов на уроках физики Ремонт генератора
Ремонт генератора Развитие познавательного интереса к предмету физика
Развитие познавательного интереса к предмету физика Автобус, двигаясь прямолинейно и равноускоренно
Автобус, двигаясь прямолинейно и равноускоренно Основные законы социальной динамики. Лекция 3
Основные законы социальной динамики. Лекция 3