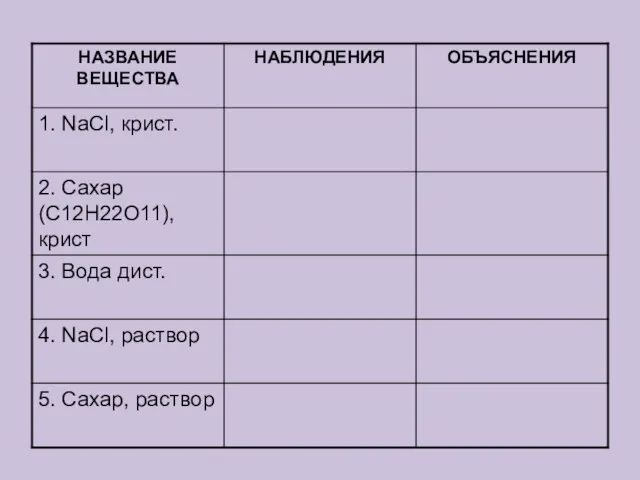
Содержание
- 2. Тест 1. Выберите вещество с ковалентной неполярной связью: А) NaCl; б) О2; в) AlCl3; г) H2O
- 4. Строение молекулы воды Связь Н-О ковалентная полярная
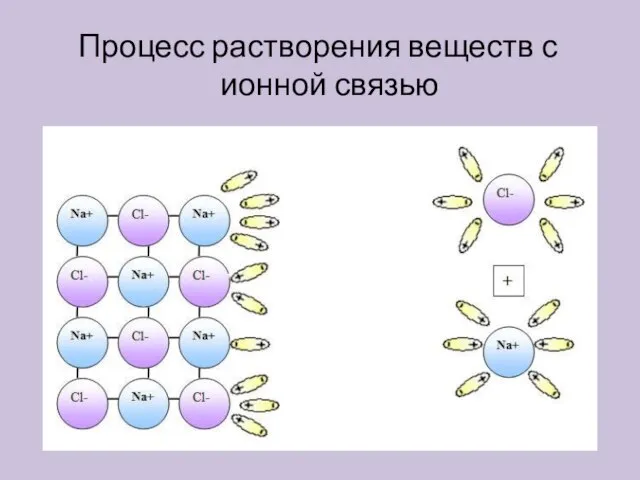
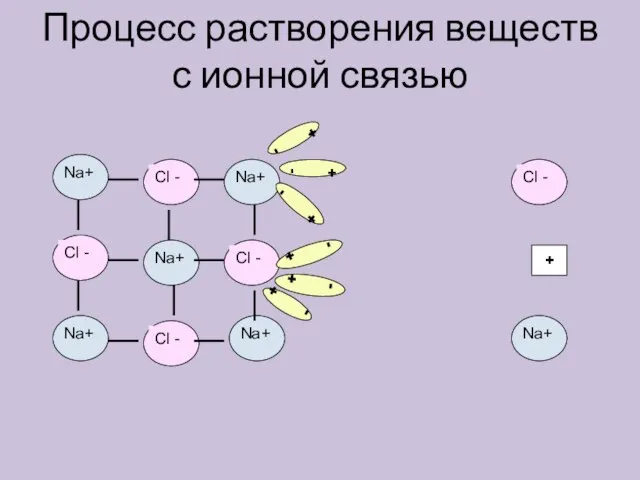
- 6. Процесс растворения веществ с ионной связью
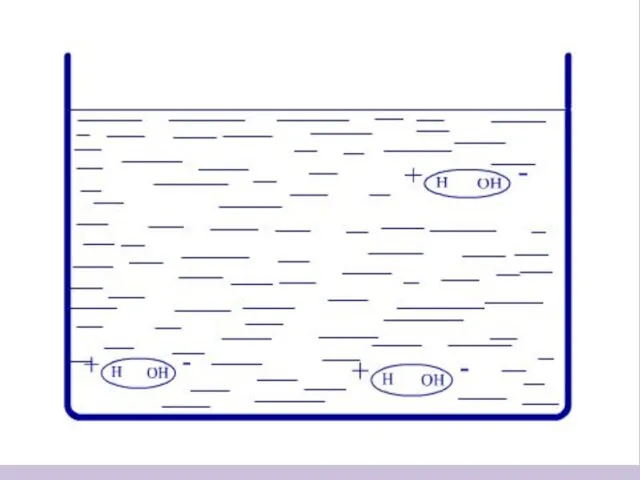
- 7. Процесс растворения веществ с ионной связью + - + - + - + - + -
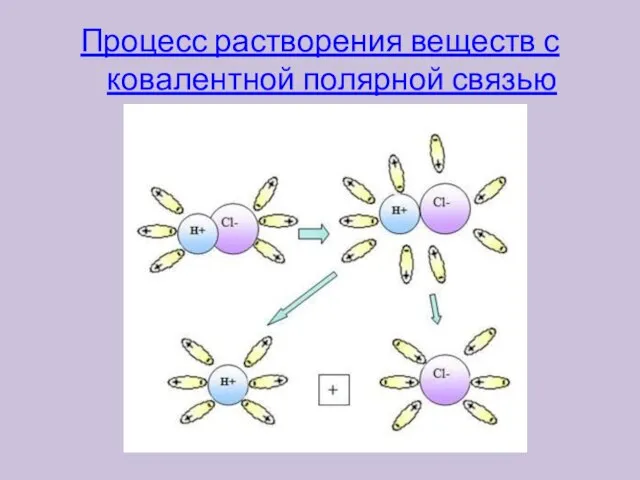
- 8. Процесс растворения веществ с ковалентной полярной связью
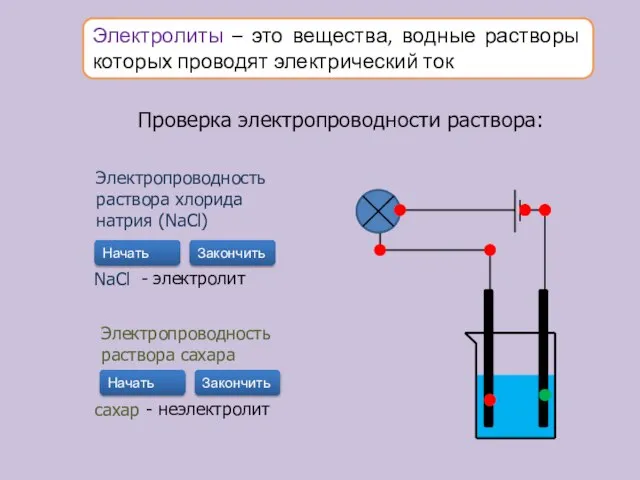
- 10. Электролиты – это вещества, водные растворы которых проводят электрический ток Проверка электропроводности раствора: Электропроводность раствора хлорида
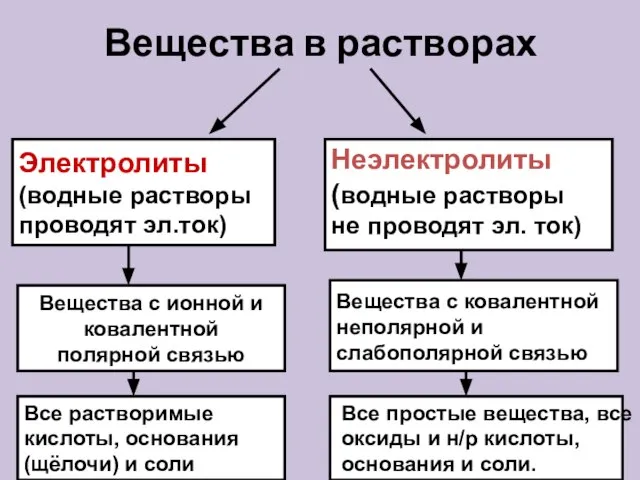
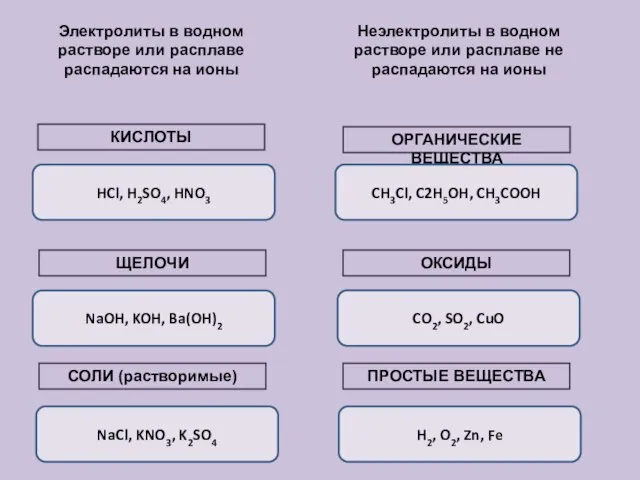
- 11. Вещества в растворах Электролиты (водные растворы проводят эл.ток) Неэлектролиты (водные растворы не проводят эл. ток) Вещества
- 12. Электролиты в водном растворе или расплаве распадаются на ионы Неэлектролиты в водном растворе или расплаве не
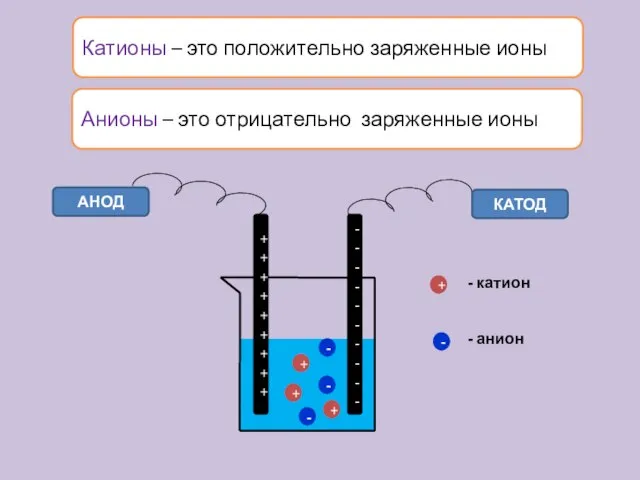
- 13. Катионы – это положительно заряженные ионы АНОД КАТОД + + + - - - + -
- 14. Типы ионов По заряду: катионы (положительные) и анионы (отрицательные); По отношению к воде: Гидратированные и негидратированные
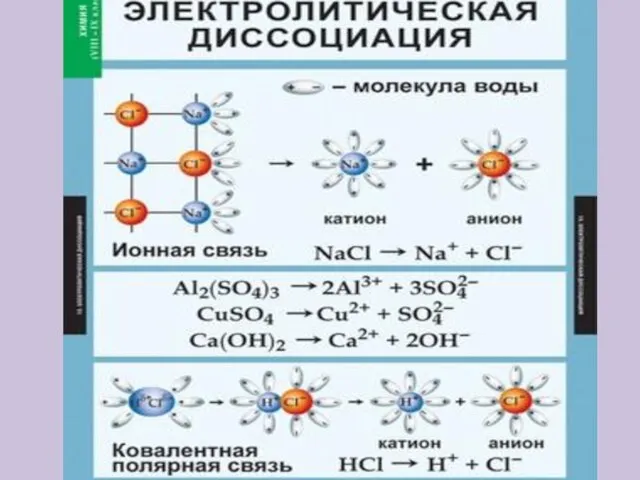
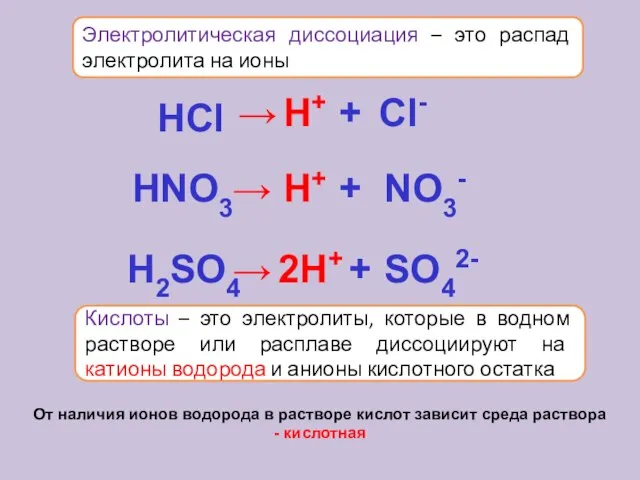
- 15. Электролитическая диссоциация – это распад электролита на ионы Кислоты – это электролиты, которые в водном растворе
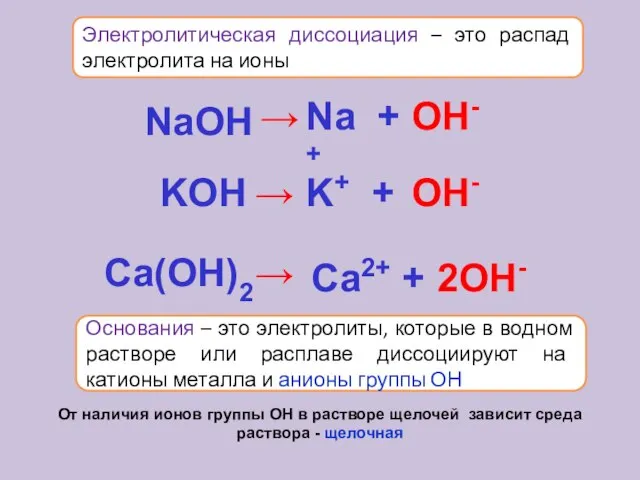
- 16. Электролитическая диссоциация – это распад электролита на ионы Основания – это электролиты, которые в водном растворе
- 17. Электролитическая диссоциация – это распад электролита на ионы Соли – это электролиты, которые в водном растворе
- 18. Упрощённо процесс диссоциации изображают с помощью уравнений диссоциации: NaCl = Na+ + Cl- HCl = H+
- 20. Скачать презентацию





 Подвижной состав автотранспорта
Подвижной состав автотранспорта Термодинамика. Внутренняя энергия
Термодинамика. Внутренняя энергия Плотность вещества
Плотность вещества Робот - Снегоуборщик
Робот - Снегоуборщик Плотность вещества
Плотность вещества Презентация на тему Определение цены деления прибора
Презентация на тему Определение цены деления прибора  Взвешивая время
Взвешивая время Кинематика материальной точки
Кинематика материальной точки Интерференция и дифракция света. Задачи
Интерференция и дифракция света. Задачи Нанотехнологии в современном мире
Нанотехнологии в современном мире Определение электромагнитного поля. Практическое занятие
Определение электромагнитного поля. Практическое занятие Нанотехнологии и их применение
Нанотехнологии и их применение Длина пути машинки с крутой и пологой горки
Длина пути машинки с крутой и пологой горки Як використати саморобний тепло - механічний двигун для демонстрації фізичних явищ
Як використати саморобний тепло - механічний двигун для демонстрації фізичних явищ Методы получения вакуума
Методы получения вакуума Электростатика вакуума и проводников
Электростатика вакуума и проводников Определение коэффициента поверхностного натяжения синтетических моющих средств
Определение коэффициента поверхностного натяжения синтетических моющих средств Взаимодействие тел. Масса
Взаимодействие тел. Масса Понятие о газах
Понятие о газах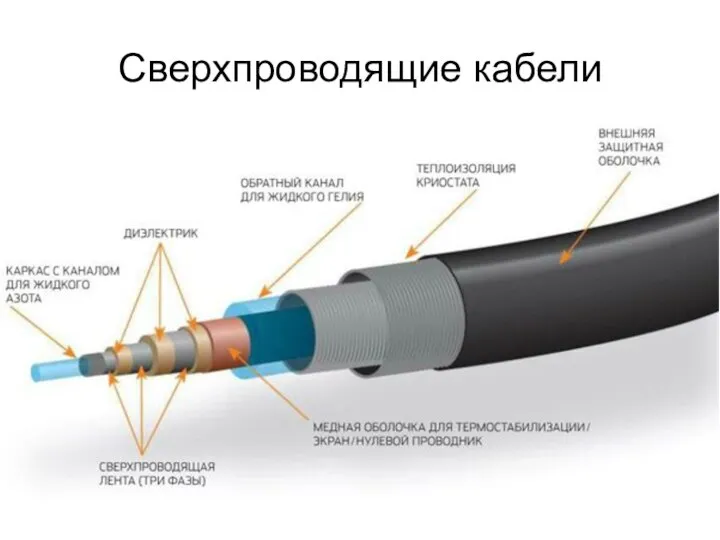 Сверхпроводящие кабели
Сверхпроводящие кабели Строение вещества. Атомы и молекулы
Строение вещества. Атомы и молекулы Смесительный бак с регулированием уровня и температуры. Пример
Смесительный бак с регулированием уровня и температуры. Пример Поляризация света. Голография. Лекция 16-17
Поляризация света. Голография. Лекция 16-17 Мехатроника
Мехатроника Надёжность электрических машин. Надёжность контактных колец и подшипниковых узлов электрических машин
Надёжность электрических машин. Надёжность контактных колец и подшипниковых узлов электрических машин Электрический ток в вакууме
Электрический ток в вакууме Презентация на тему Спектр электромагнитных волн
Презентация на тему Спектр электромагнитных волн  Презентация
Презентация