Содержание
- 2. Проверка домашнего материала: Как назвали способность атомов некоторых химических элементов к самопроизвольному излучению? Как были названы
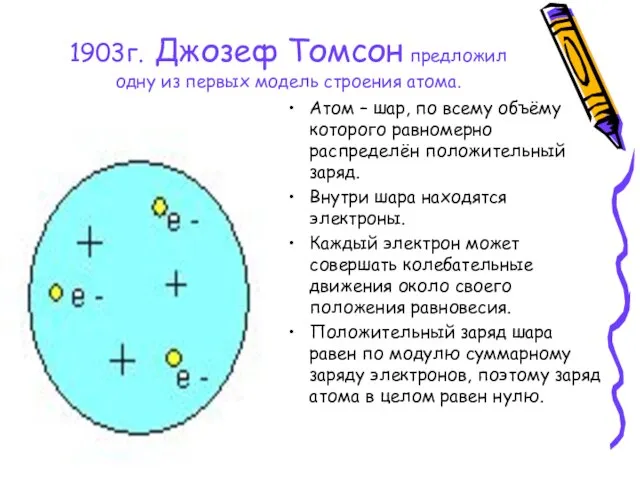
- 3. 1903г. Джозеф Томсон предложил одну из первых модель строения атома. Атом – шар, по всему объёму
- 4. Модель Томсона нуждалась в экспериментальной проверке. Важно было проверить, действительно ли положительный заряд распределён по всему
- 5. Идея опыта Резерфорда: Зондировать атом альфа–частицами. Альфа-частицы возникают при распаде радия. Масса альфа-частицы в 8000 раз
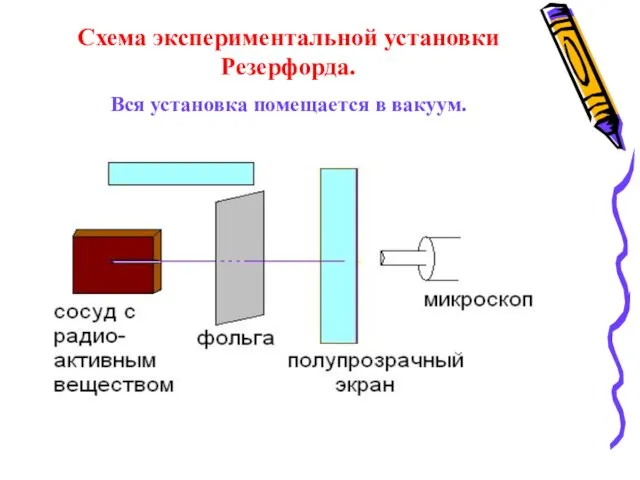
- 6. Схема экспериментальной установки Резерфорда. Вся установка помещается в вакуум.
- 7. В ходе эксперимента обнаружили: 1. В отсутствии фольги – на экране появлялся светлый кружок напротив канала
- 8. Противоречие модели Томсона с экспериментом: 1. Так как масса электронов мала, они не могут заметно изменить
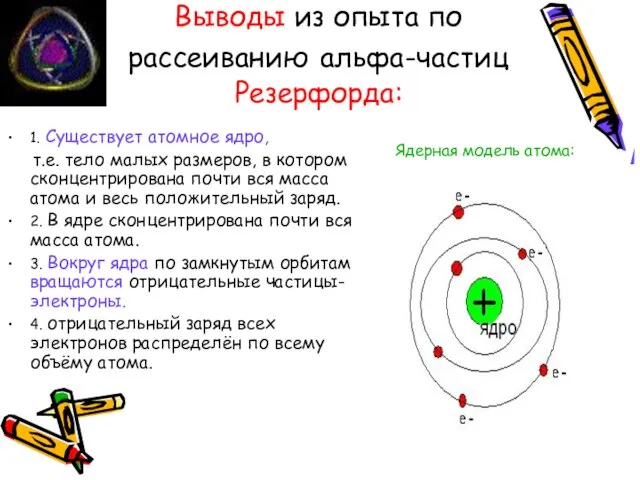
- 9. Выводы из опыта по рассеиванию альфа-частиц Резерфорда: 1. Существует атомное ядро, т.е. тело малых размеров, в
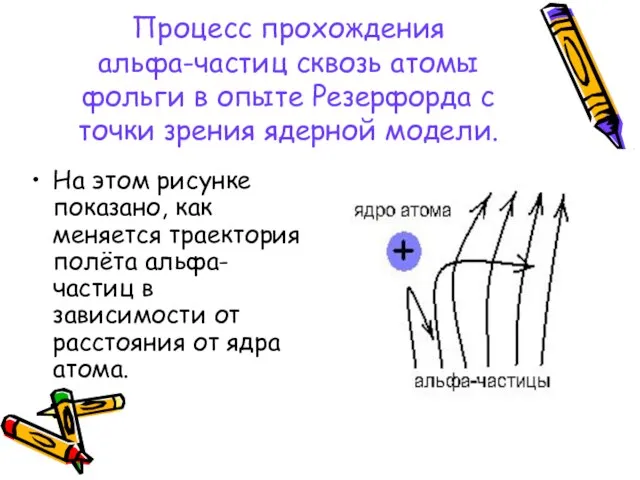
- 10. Процесс прохождения альфа-частиц сквозь атомы фольги в опыте Резерфорда с точки зрения ядерной модели. На этом
- 11. Недостаток планетарной модели атома: Нельзя объяснить факт существования атома; Нельзя объяснить устойчивость атома.
- 13. Скачать презентацию






 Программа для решения физических задач
Программа для решения физических задач Lect_4
Lect_4 Сила. Силы в природе и Работа. Мощность
Сила. Силы в природе и Работа. Мощность Сложение двух сил, направленных по одной прямой. Равнодействующая сила
Сложение двух сил, направленных по одной прямой. Равнодействующая сила Основы термодинамики. Лекция 2.3
Основы термодинамики. Лекция 2.3 Бизнес идея: Практичный домкрат для автомобилей
Бизнес идея: Практичный домкрат для автомобилей Применение ядерной энергии в различных отраслях. Доза радиоактивного излучения. Применение ядерного оружия
Применение ядерной энергии в различных отраслях. Доза радиоактивного излучения. Применение ядерного оружия Молекулярно-кинетическая теория (презентации к системе уроков)
Молекулярно-кинетическая теория (презентации к системе уроков) Викторина по физике 9 класс
Викторина по физике 9 класс Электромагнетизм
Электромагнетизм Презентация на тему Электростатика
Презентация на тему Электростатика  Принцип Даламбера для материальной точки. Лекция 2
Принцип Даламбера для материальной точки. Лекция 2 Презентация на тему Альберт Эйнштейн
Презентация на тему Альберт Эйнштейн  Классификация магнитных материалов специального назначения. (Лекция 8)
Классификация магнитных материалов специального назначения. (Лекция 8) Визначення температури спалаху та самозапалення нафтопродуктів. Практичне заняття № 6
Визначення температури спалаху та самозапалення нафтопродуктів. Практичне заняття № 6 Механическая работа
Механическая работа Измерение количества и расхода жидкости и газа в практике горно-буровых работ
Измерение количества и расхода жидкости и газа в практике горно-буровых работ Польза и вред электризации
Польза и вред электризации Газовые законы
Газовые законы Приборы и методы экспериментальной физики
Приборы и методы экспериментальной физики Энергия. 7 класс
Энергия. 7 класс Волновые процессы
Волновые процессы Презентация на тему Криволинейное движение
Презентация на тему Криволинейное движение  Перемещение при равномерном прямолинейном движении
Перемещение при равномерном прямолинейном движении Аристотель, его вклад в развитие механики
Аристотель, его вклад в развитие механики Закон Ома для участка цепи. Самостоятельная работа
Закон Ома для участка цепи. Самостоятельная работа Суд над атомом. Мультимедийный урок
Суд над атомом. Мультимедийный урок Специальная теория относительности. Постулаты теории относительности
Специальная теория относительности. Постулаты теории относительности