Содержание
- 2. Демокрит Первой наиболее перспективной научной гипотезой о строение вещ-ва была идея атомизма. Атомизм- учение о прерывистом,
- 3. Закон Дальтона Оба закона Дальтона строго выполняются для идеальных газов. Для реальных газов эти законы применимы
- 4. Отто фон Генрике Отто фон Генрике (20.11.1602-11.05.1686) - немецкий физик. Родился в Магдебурге. В 1617-1623 годах
- 5. Отто Штерн В 1920 году физиком Отто Штерном (1888-1969) впервые были экспериментально определены скорости частиц вещества.
- 6. Уравнение Клапейрона - Менделеева Уравнение состояния термодинамической системы представляет собой аналитическую формулу, связывающую параметры состояния системы.
- 7. Закон Бойля-Мариотта Научная деятельность Роберта Бойля была основана на экспериментальном методе и в физике, и в
- 8. Амедео Авогадро Закон Авогадро в современном виде звучит так: "Моль любого вещества в газообразном состоянии при
- 9. Закон Гей - Люссака В 1808 Гей-Люссак открыл закон объёмных отношений, согласно которому объемы газов, вступающих
- 10. Закон Шарля Один из основных газовых законов, согласно которому давление данной массы идеального газа при постоянном
- 11. Ученые-химики, участвовавшие в праздновании 200-летия Берлинской Академии наук Слева- направо стоят: А. Ладенбург, С. Йоргенсон, Э.
- 13. Скачать презентацию
Слайд 2Демокрит
Первой наиболее перспективной научной гипотезой о строение вещ-ва была идея атомизма. Атомизм-
Демокрит
Первой наиболее перспективной научной гипотезой о строение вещ-ва была идея атомизма. Атомизм-

Слайд 3Закон Дальтона
Оба закона Дальтона строго выполняются для идеальных газов. Для реальных газов
Закон Дальтона
Оба закона Дальтона строго выполняются для идеальных газов. Для реальных газов

(p+an2/V2 ) (V-nb) = nRT или p = nRT/(V-nb) - an2/V2,
где p, T, n - давление, температура и количество молей газа, соответственно, R - универсальная газовая постоянная, a и b - константы, характеризующие силы притяжения и отталкивания между молекулами газа. Для неплотных газов, когда nb<
Видно, что давление реального газа отличается от давления идеального на величину, пропорциональную bRT-a, которая может быть как больше, так и меньше нуля (все определяется тем, какие силы между молекулами преобладают - отталкивания или притяжения). Допустим, мы смешиваем два неплотных реальных газа, у которых константы a и b идентичны (например, изотопы). Тогда:
p1 = n1RT/V + (bRT-a)n12/V2, p2 = n2RT/V + (bRT-a)n22/V2, pсм = (n1+n2) RT/V + (bRT-a)(n1+n2)2/V2,
где p1, p2, pсм - давление первого газа, второго газа и их смеси соответственно. Легко получить, что Dp = pсм - p1 - p2 = 2(bRT - a)n1n2/V2. Таким образом, при T > a/bR давление смеси газов будет больше суммы парциальных давлений, при T < a/bR давление смеси газов будет меньше суммы парциальных давлений, а при T = a/bR закон Дальтона будет выполняться.
Слайд 4Отто фон Генрике
Отто фон Генрике (20.11.1602-11.05.1686) - немецкий физик. Родился в Магдебурге.
Отто фон Генрике
Отто фон Генрике (20.11.1602-11.05.1686) - немецкий физик. Родился в Магдебурге.

Изобрел воздушный насос и, усовершенствовав его, осуществил ряд опытов: продемонстрировал в 1654 году существование давления воздуха (опыт с "магдебургскими полушариями"), доказал его упругость, определил плотность, выяснил, что воздух является проводником звука, в пустоте звук не распространяется и т.п. Около 1660 года Герике построил одну из первых электростатических машин. Это был шар, который мог вращаться вокруг железного стержня как вокруг оси. Вращая шар и натирая его ладонями, Герике тем самым электризовал его. С помощью этого прибора изучал электрические явления, в частности обнаружил явление электрического отталкивания, электризацию через влияние и электрическое свечение (наблюдал в темноте свечение наэлектризованного серного шара). Построил также первый водяной барометр (1657) и использовал его для предсказания погоды, изобрел гигрометр, построил воздушный термометр, манометр (не позже 1662).
Герике изучал магнитные явления, заметил намагничивание длинных железных предметов, расположенных при ковке в меридиональном направлении. Обратил внимание на уменьшение интенсивности света при отражении. Автор трактата "Новые, так называемые магдебургские опыты с пустым пространством" (1672). Доказал, что давление идеального газа равно двум третям средней кинетической энергии поступательного движения молекул, содержащихся в единице объёма.
Слайд 5Отто Штерн
В 1920 году физиком Отто Штерном (1888-1969) впервые были экспериментально определены
Отто Штерн
В 1920 году физиком Отто Штерном (1888-1969) впервые были экспериментально определены

Слайд 6Уравнение Клапейрона - Менделеева
Уравнение состояния термодинамической системы представляет собой аналитическую формулу, связывающую
Уравнение Клапейрона - Менделеева
Уравнение состояния термодинамической системы представляет собой аналитическую формулу, связывающую

Конкретный вид этой формулы зависит от физических свойств рассматриваемой термодинамической системы.
Обобщение многочисленных экспериментальных данных показывает, что большинство газов при комнатной температуре и давлении порядка одной атмосферы (при нормальных условиях) с достаточно высокой точностью могут быть описаны уравнением состояния, называемым: уравнением Клапейрона-Мендилеева: PV=vRT
где: P- давление газа, V- занимаемый им объем, v- количество молей газа, R- универсальная газовая постоянная, T- абсолютная температура. Уравнение названо в честь французского физика Бенуа Поля Эмиля Клапейрона(1799 - 1864) и русского химика Дмитрия Ивановича Менделеева(1834 - 1907).
В рамках термодинамического подхода газ, уравнение состояния которого, связывающие параметрыP, V, иT, является уравнением Клапейрона-Менделеева называется идеальным газом. При нормальных условиях наиболее близкими по своим свойствам к идеальному газу являются водород и гелий.
Подробный анализ уравнения начнем с обсуждения величиныT, которая называется абсолютной температурой. Из формулы следует, что при постоянном объеме и количестве вещества температура Tпропорциональна давлению идеального газа P. А это означает, что если измерение температуры проводить с помощью газового термометра постоянного объема, в качестве рабочего тела в котором используется идеальный газ, то такой термометр будет иметь линейную шкалу температур. Очевидно, что использование газового термометра для определения абсолютной температуры ограничено, так как в качестве термометрического тела может быть использован только реальный газ, свойства которого отличны от идеального, и для которого уравнение является приближенным. При низких температурах реальный газ переходит в жидкое состояние, что делает невозможным его использование при этих температурах в качестве рабочего тела газового термометра.
Слайд 7Закон Бойля-Мариотта
Научная деятельность Роберта Бойля была основана на экспериментальном методе и
Закон Бойля-Мариотта
Научная деятельность Роберта Бойля была основана на экспериментальном методе и

Слайд 8Амедео Авогадро
Закон Авогадро в современном виде звучит так: "Моль любого вещества
Амедео Авогадро
Закон Авогадро в современном виде звучит так: "Моль любого вещества

Слайд 9Закон Гей - Люссака
В 1808 Гей-Люссак открыл закон объёмных отношений, согласно которому
Закон Гей - Люссака
В 1808 Гей-Люссак открыл закон объёмных отношений, согласно которому
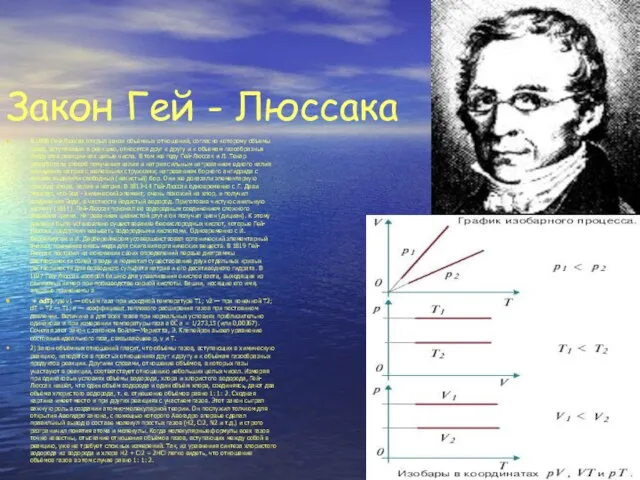
+ adT),где v1 — объём газа при исходной температуре T1; v2 — при конечной T2; dT = T2 — T1; a — коэффициент теплового расширения газов при постоянном давлении. Величина a для всех газов при нормальных условиях приблизительно одинакова и при измерении температуры газа в 0С a = 1/273,15 (или 0,00367). Сочетая этот закон с законом Бойля—Мариотта, Э. Клапейрон вывел уравнение состояния идеального газа, связывающее р, v и Т.
2) Закон объёмных отношений гласит, что объёмы газов, вступающих в химическую реакцию, находятся в простых отношениях друг к другу и к объёмам газообразных продуктов реакции. Другими словами, отношение объёмов, в которых газы участвуют в реакции, соответствует отношению небольших целых чисел. Измеряя при одинаковых условиях объёмы водорода, хлора и хлористого водорода, Гей-Люссак нашёл, что один объём водорода и один объём хлора, соединяясь, дают два объёма хлористого водорода, т. е. отношение объёмов равно 1: 1: 2. Сходная картина имеет место и при других реакциях с участием газов. Этот закон сыграл важную роль в создании атомно-молекулярной теории. Он послужил толчком для открытия Авогадро закона, с помощью которого Авогадро впервые сделал правильный вывод о составе молекул простых газов (H2, Cl2, N2 и т.д.) и строго разграничил понятия атома и молекулы. Когда молекулярные формулы всех газов точно известны, отыскание отношения объёмов газов, вступающих между собой в реакцию, уже не требует сложных измерений. Так, из уравнения синтеза хлористого водорода из водорода и хлора Н2 + Cl2 = 2HCl легко видеть, что отношение объёмов газов в этом случае равно 1: 1: 2.
Слайд 10Закон Шарля
Один из основных газовых законов, согласно которому давление данной массы идеального
Закон Шарля
Один из основных газовых законов, согласно которому давление данной массы идеального

pt=p0(1+Bt), где pt p0- давление газа при температуре t и 0 С соответственно, B=1/273.17k- температурный коэфицент давления. Установлен в 1787г. французским учёным Ж. Шарлем (1746-1823)
Слайд 11Ученые-химики, участвовавшие в праздновании 200-летия Берлинской Академии наук
Слева- направо стоят: А.
Ученые-химики, участвовавшие в праздновании 200-летия Берлинской Академии наук
Слева- направо стоят: А.

 Влажность воздуха
Влажность воздуха Физика твердой Земли. Геотермия
Физика твердой Земли. Геотермия Снежные причуды. Всё о снеге и снежинках
Снежные причуды. Всё о снеге и снежинках Источники света. Распространение света
Источники света. Распространение света Электрическое сопротивление
Электрическое сопротивление Международная система единиц СИ
Международная система единиц СИ Свободное падение тел
Свободное падение тел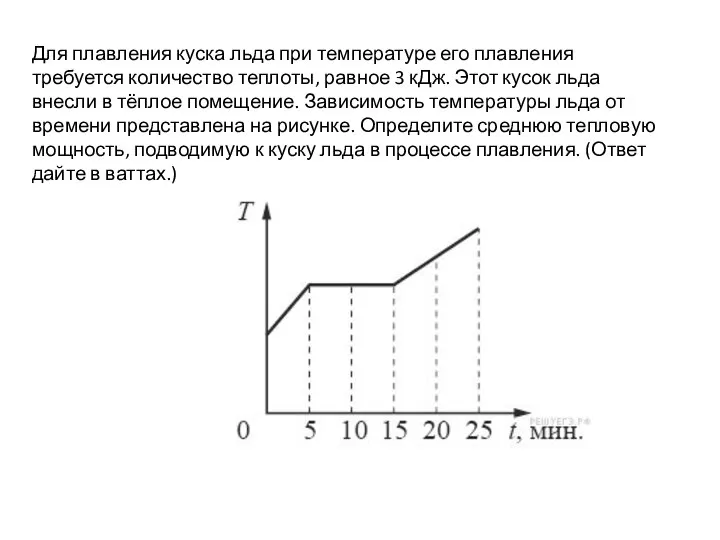 Определение тепловой мощности. ВПР, 9 класс
Определение тепловой мощности. ВПР, 9 класс Применение последовательного анализа и правила Вальда в задачах контроля
Применение последовательного анализа и правила Вальда в задачах контроля 13. СВЕТОТЕХНИКА 2020
13. СВЕТОТЕХНИКА 2020 Кинематика плоскопараллельного движения абсолютно твердого тела и сложного движения точки
Кинематика плоскопараллельного движения абсолютно твердого тела и сложного движения точки Качество обработанной поверхности
Качество обработанной поверхности Тепловое расширение тел
Тепловое расширение тел Что изучает физика?
Что изучает физика? Методика измерения массовой концентрации общего фосфора и фосфора фосфатов в пробах питьевых, природных и сточных вод
Методика измерения массовой концентрации общего фосфора и фосфора фосфатов в пробах питьевых, природных и сточных вод Радиоактивность и радиационно-опасные объекты
Радиоактивность и радиационно-опасные объекты Основы постановки научного эксперимента. ЯМР-спектроскопия. (Лекция 8)
Основы постановки научного эксперимента. ЯМР-спектроскопия. (Лекция 8) Введение в теплотехнику
Введение в теплотехнику Опыт Милликена. АФ1.4
Опыт Милликена. АФ1.4 Звуковые волны
Звуковые волны Кинематика точки
Кинематика точки Тезаурус
Тезаурус Волновые свойства света
Волновые свойства света Виды зубчатых передач
Виды зубчатых передач Мехатроника и мобильная робототехника
Мехатроника и мобильная робототехника Статистическая радиотехника. Узкополосный случайный процесс
Статистическая радиотехника. Узкополосный случайный процесс Методические указания к выполнению отчета по лабораторным работам
Методические указания к выполнению отчета по лабораторным работам ВКР: Разработка технологии ремонта форсунок дизельных двигателей автомобилей
ВКР: Разработка технологии ремонта форсунок дизельных двигателей автомобилей