Содержание
- 2. Цель: повторение основных понятий, законов и формул МОЛЕКУЛЯРНОЙ ФИЗИКИ в соответствии с кодификатором ЕГЭ. Элементы содержания,
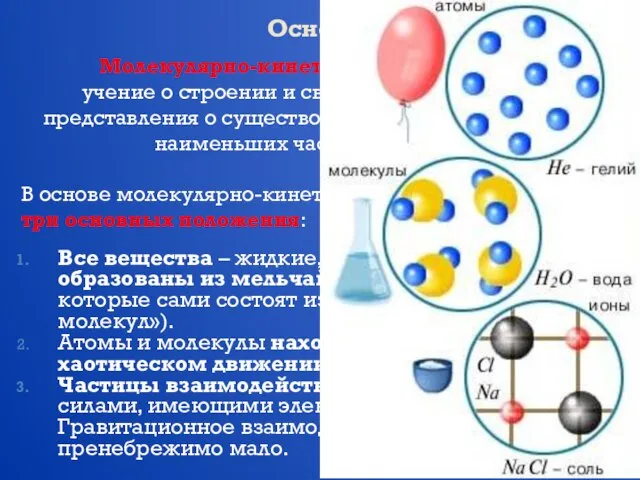
- 3. Основные положения МКТ Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе представления о
- 4. Модели строения газов, жидкостей и твердых В твердых телах молекулы совершают беспорядочные колебания около фиксированных центров
- 5. Тепловое движение атомов и молекул Беспорядочное хаотическое движение молекул называется тепловым движением. Тепловое движение атомов в
- 6. Броуновское движение Диффузия Броуновское движение - это тепловое движение мельчайших частиц, взвешенных в жидкости или газе.
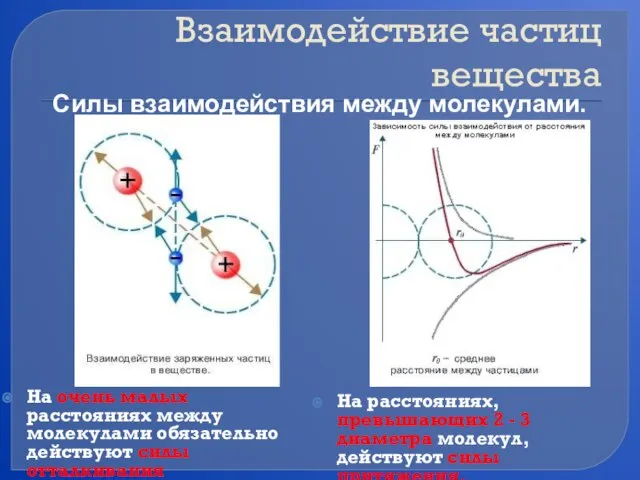
- 7. Взаимодействие частиц вещества На очень малых расстояниях между молекулами обязательно действуют силы отталкивания На расстояниях, превышающих
- 8. Модель идеального газа Моль – это количество вещества, содержащее столько же частиц (молекул), сколько содержится атомов
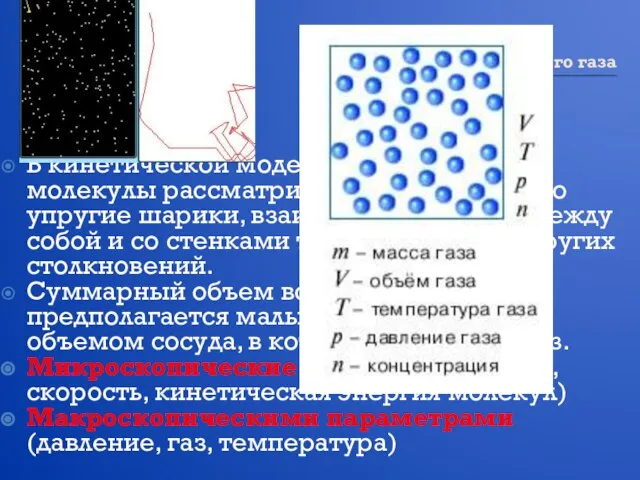
- 9. Модель идеального газа В кинетической модели идеального газа молекулы рассматриваются как идеально упругие шарики, взаимодействующие между
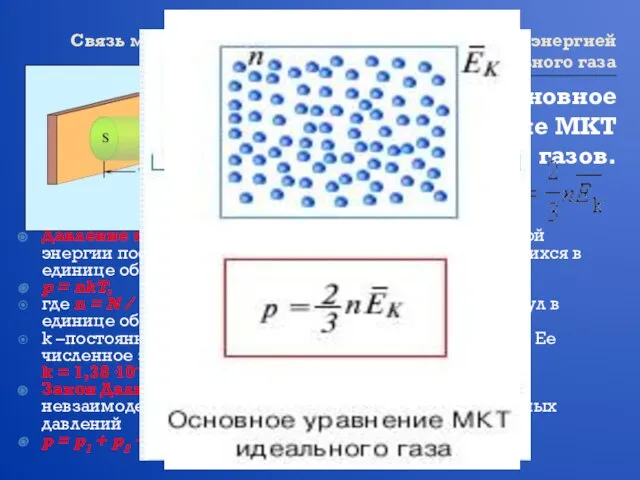
- 10. Связь между давлением и средней кинетической энергией теплового движения молекул идеального газа Основное уравнение МКТ газов.
- 11. Абсолютная температура Абсолютная температура как мера средней кинетической энергии его частиц Тепловое равновесие – это такое
- 12. Абсолютная температура Абсолютная температура как мера средней кинетической энергии его частиц Средняя кинетическая энергия хаотического движения
- 13. Уравнение Менделеева-Клапейрона Уравнение состояния идеального газа. Произведение постоянной Авогадро NA на постоянную Больцмана k называется универсальной
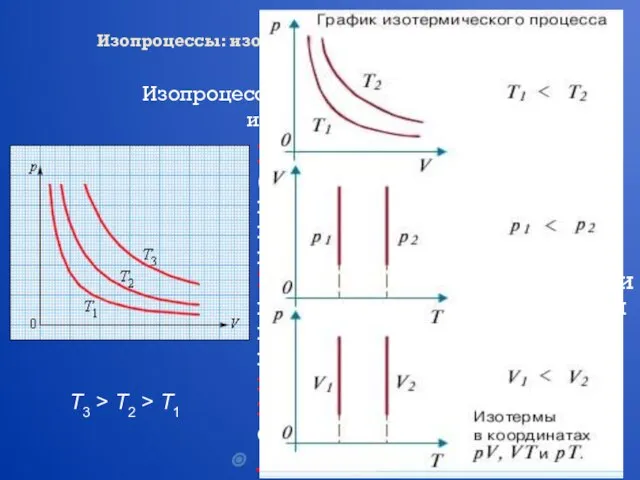
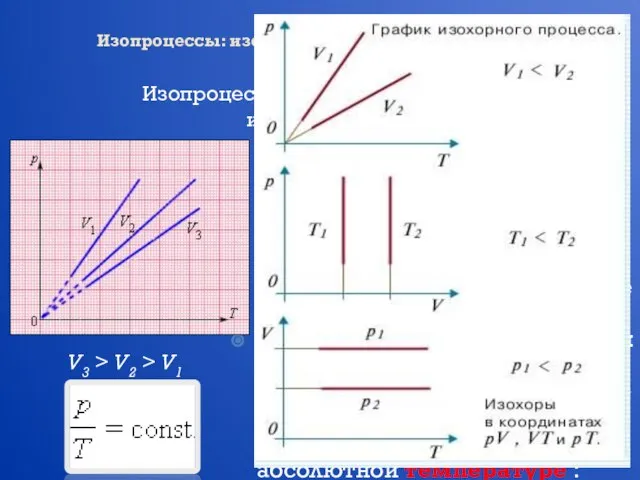
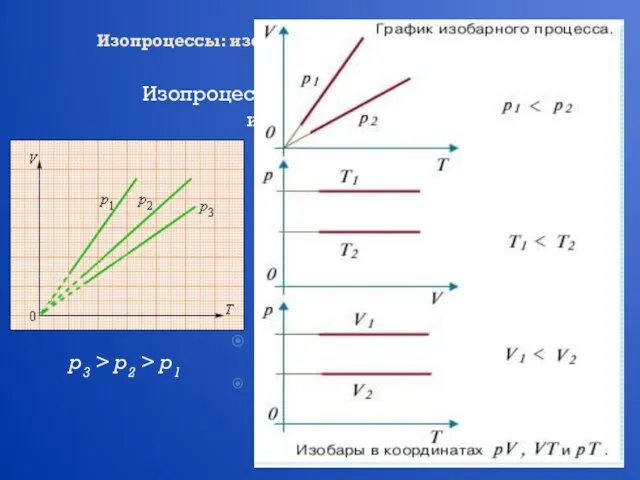
- 14. Изопроцессы: изотермический, изохорный, изобарный, адиабатный процессы Изопроцессы – это процессы, в которых один из параметров (p,
- 15. Изопроцессы: изотермический, изохорный, изобарный, адиабатный процессы Изопроцессы – это процессы, в которых один из параметров (p,
- 16. Изопроцессы: изотермический, изохорный, изобарный, адиабатный процессы Изопроцессы – это процессы, в которых один из параметров (p,
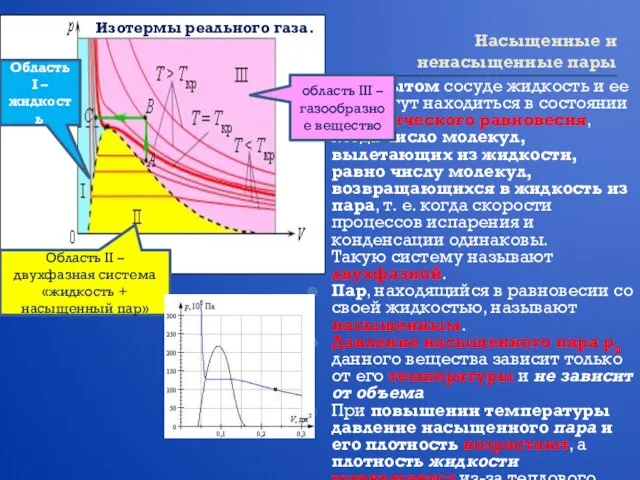
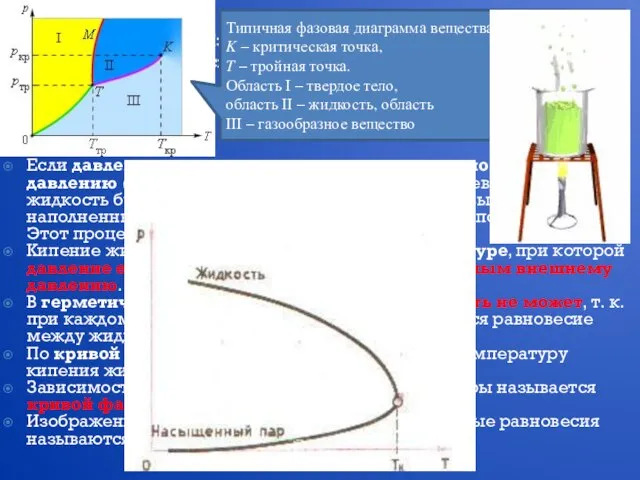
- 17. Насыщенные и ненасыщенные пары В закрытом сосуде жидкость и ее пар могут находиться в состоянии динамического
- 18. Влажность воздуха Отношение p / p0, выраженное в процентах, называется относительной влажностью воздуха В атмосферном воздухе
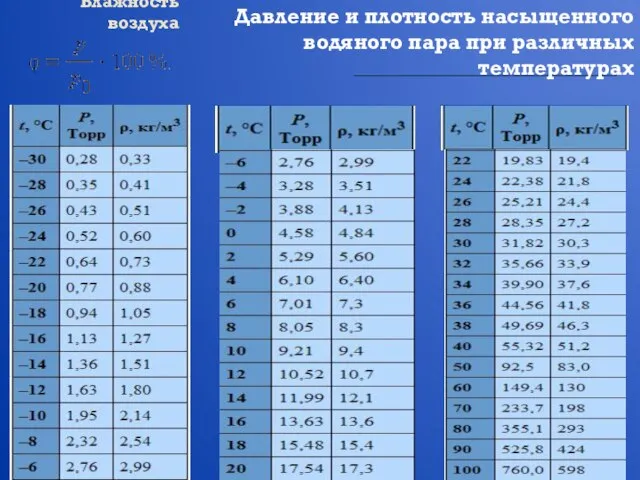
- 19. Влажность воздуха Давление и плотность насыщенного водяного пара при различных температурах
- 20. Изменение агрегатных состояний вещества: испарение и конденсация, кипение жидкости Переход из одного состояния в другое называется
- 21. Изменение агрегатных состояний вещества: испарение и конденсация, кипение жидкости Переход из одного состояния в другое называется
- 22. Изменение агрегатных состояний вещества: плавление и кристаллизация Плавление — переход из кристаллического твёрдого состояния в жидкое.
- 23. Молекулярно-кинетическая теория. Основные формулы Основы молекулярно-кинетической теории: NA – постоянная Авогадро. Основное уравнение МКТ идеального газа:
- 24. Молекулярно-кинетическая теория. Основные формулы Изотермический процесс (закон Бойля-Мариотта): Изохорный процесс (закон Шарля): Изобарный процесс (закон Гей-Люссака):
- 25. Словарь по Молекулярной Физике и Тепловым Явлениям Абсолютная влажность(р) - парциальное давление водяных паров, содержащихся в
- 26. Словарь по Молекулярной Физике и Тепловым Явлениям Деформация - изменение формы или размеров тела (или части
- 27. Словарь по Молекулярной Физике и Тепловым Явлениям Идеальный газ - модель, в которой не учитывается взаимодействие
- 28. Словарь по Молекулярной Физике и Тепловым Явлениям Молекула - наименьшая частица данного вещества, обладающая его основными
- 29. Словарь по Молекулярной Физике и Тепловым Явлениям Парообразование - процесс перехода вещества из жидкого или твердого
- 30. Словарь по Молекулярной Физике и Тепловым Явлениям Твердые тела - агрегатное состояние вещества, характеризующееся стабильностью формы
- 31. Словарь по Молекулярной Физике и Тепловым Явлениям Удельная теплоемкость (с) - физическая величина, показывающая, какое количество
- 32. Рассмотрим задачи: ЕГЭ 2001-2010 (Демо, КИМ) ГИА-9 2008-2010 (Демо)
- 33. (ЕГЭ 2001 г.) А10. Согласно расчетам, температура жидкости должна быть равна 143 К. Между тем термометр
- 34. (ЕГЭ 2001 г., Демо) А11. На рисунке показана часть шкалы термометра, висящего за окном. Температура воздуха
- 35. (ЕГЭ 2001 г.) А12. Кастрюлю с водой поставили на газовую плиту. Газ горит постоянно. Зависимость температуры
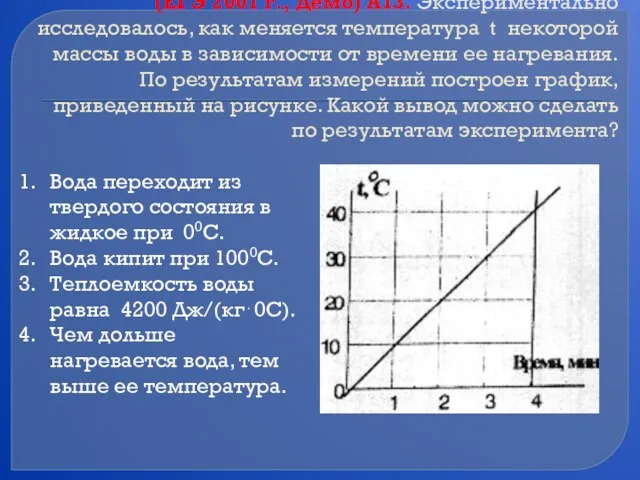
- 36. (ЕГЭ 2001 г., Демо) А13. Экспериментально исследовалось, как меняется температура t некоторой массы воды в зависимости
- 37. (ЕГЭ 2001 г., Демо) А14. Испарение жидкости происходит потому, что . . . разрушается кристаллическая решетка.
- 38. (ЕГЭ 2001 г., Демо) А15. Тела, имеющие разные температуры, привели в соприкосновение двумя способами ( I
- 39. (ЕГЭ 2001 г.) А33. Представления о строении вещества в XVIII веке не позволяли получить объяснения закона
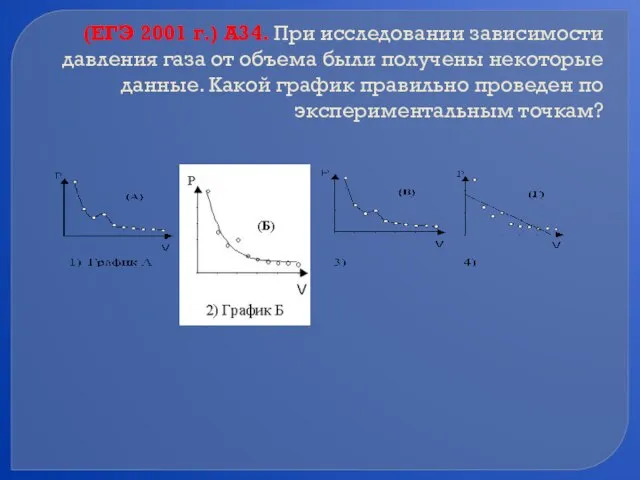
- 40. (ЕГЭ 2001 г.) А34. При исследовании зависимости давления газа от объема были получены некоторые данные. Какой
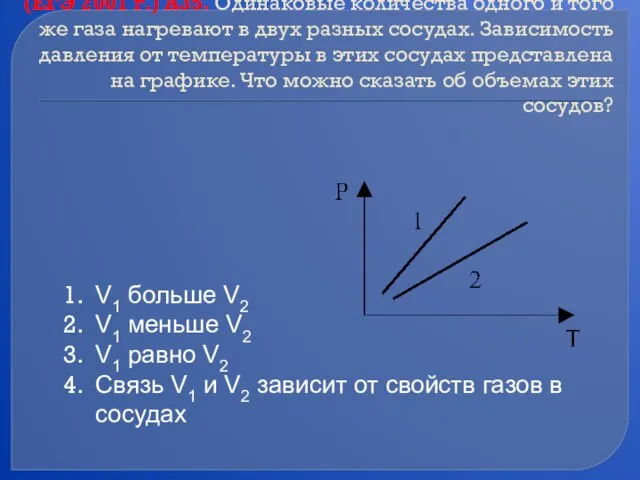
- 41. (ЕГЭ 2001 г.) А35. Одинаковые количества одного и того же газа нагревают в двух разных сосудах.
- 42. (ЕГЭ 2002 г., Демо) А8. Какой из перечисленных ниже опытов (А, Б или В) подтверждает вывод
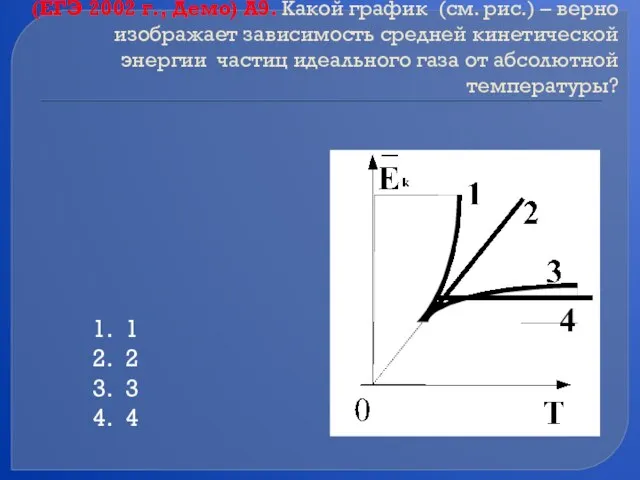
- 43. (ЕГЭ 2002 г., Демо) А9. Какой график (см. рис.) – верно изображает зависимость средней кинетической энергии
- 44. 2002 г. А9 (КИМ). В баллоне находится 6 моль газа. Сколько примерно молекул газа находится в
- 45. (ЕГЭ 2002 г., Демо) А12. Какой из графиков, изображенных на рисунке соответствует процессу, проведенному при постоянной
- 46. (ЕГЭ 2002 г., Демо) А13. При испарении жидкость остывает. Молекулярно-кинетическая теория объясняет это тем, что чаще
- 47. 2002 г. А13 (КИМ). При сжатии идеального газа объем уменьшился в 2 раза, а температура газа
- 48. 2002 г. А14 (КИМ). В результате нагревания газа средняя кинетическая энергия теплового движения его молекул увеличилась
- 49. 2002 г. А29 (КИМ). Идеальный газ сначала нагревался при постоянном давлении, потом его давление увеличивалось при
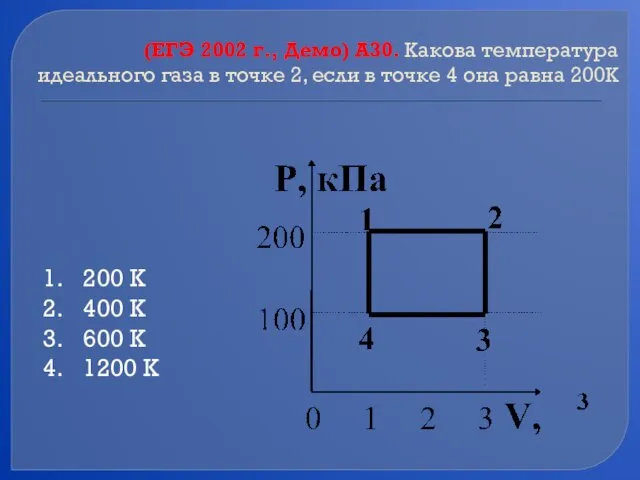
- 50. (ЕГЭ 2002 г., Демо) А30. Какова температура идеального газа в точке 2, если в точке 4
- 51. (ЕГЭ 2003 г., КИМ) А8. Диффузия происходит быстрее при повышении температуры вещества, потому что увеличивается скорость
- 52. (ЕГЭ 2003 г., КИМ) А9. При неизменной концентрации частиц идеального газа средняя кинетическая энергия теплового движения
- 53. (ЕГЭ 2003 г., КИМ) А10. На рисунке изображен график зависимости давления газа на стенки сосуда от
- 54. (ЕГЭ 2003 г., КИМ) А13. Температура кипения воды зависит от мощности нагревателя вещества сосуда, в котором
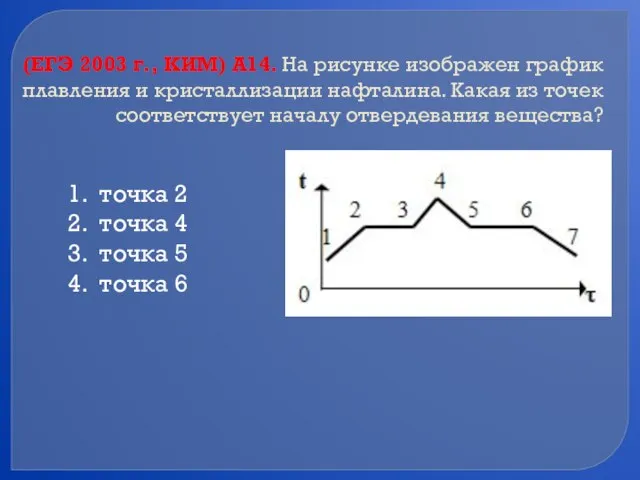
- 55. (ЕГЭ 2003 г., КИМ) А14. На рисунке изображен график плавления и кристаллизации нафталина. Какая из точек
- 56. (ЕГЭ 2004 г., демо) А7. Давление идеального газа зависит от А. концентрации молекул. Б. средней кинетической
- 57. (ЕГЭ 2004 г., демо) А10. Весной при таянии льда в водоеме температура окружающего воздуха уменьшается увеличивается
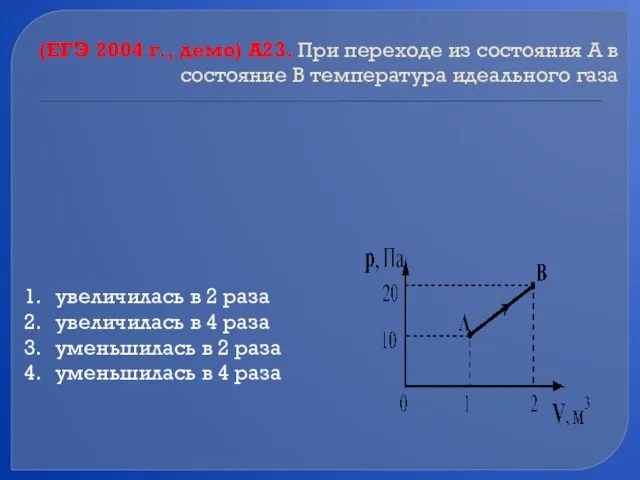
- 58. (ЕГЭ 2004 г., демо) А23. При переходе из состояния А в состояние В температура идеального газа
- 59. (ЕГЭ 2004 г., демо) А24. Идеальному газу сообщили количество теплоты 400 Дж. Газ расширился, совершив работу
- 60. 2005 г. А8 (КИМ). Если положить огурец в соленую воду, то через некоторое время он станет
- 61. (ЕГЭ 2005 г., ДЕМО) А8. Наименьшая упорядоченность в расположении частиц характерна для кристаллических тел аморфных тел
- 62. (ЕГЭ 2005 г., ДЕМО) А11. Как изменяется внутренняя энергия кристаллического вещества в процессе его плавления? увеличивается
- 63. (ЕГЭ 2005 г., ДЕМО) А13. Парциальное давление водяного пара в воздухе при 20 С равно 0,466
- 64. (ЕГЭ 2006 г., ДЕМО) А8. В жидкостях частицы совершают колебания возле положения равновесия, сталкиваясь с соседними
- 65. (ЕГЭ 2006 г., ДЕМО) А9. Лед при температуре 0С внесли в теплое помещение. Температура льда до
- 66. (ЕГЭ 2006 г., ДЕМО) А10. При какой влажности воздуха человек легче переносит высокую температуру воздуха и
- 67. (ЕГЭ 2006 г., ДЕМО) А11. Абсолютная температура тела равна 300 К. По шкале Цельсия она равна
- 68. (ЕГЭ 2006 г., ДЕМО) А27. Экспериментаторы закачивают воздух в стеклянный сосуд, одновременно охлаждая его. При этом
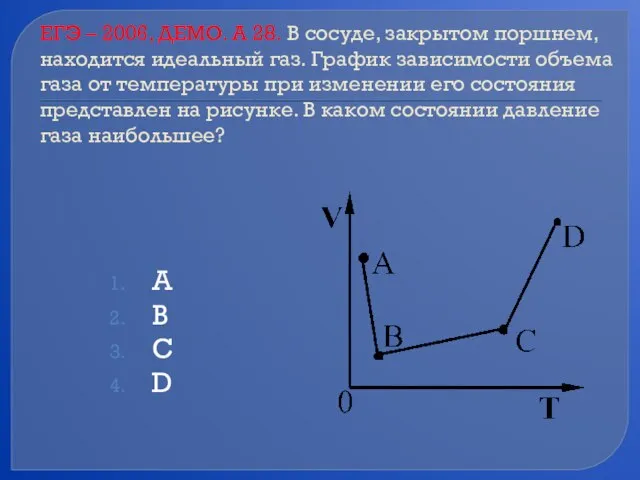
- 69. ЕГЭ – 2006, ДЕМО. А 28. В сосуде, закрытом поршнем, находится идеальный газ. График зависимости объема
- 70. (ЕГЭ 2007 г., ДЕМО) А10. 3 моль водорода находятся в сосуде при температуре Т. Какова температура
- 71. (ЕГЭ 2007 г., ДЕМО) А12. При одинаковой температуре 100С давление насыщенных паров воды равно 105 Па,
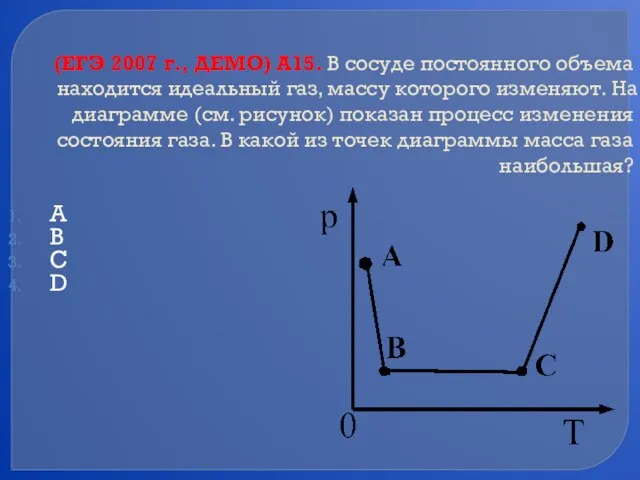
- 72. (ЕГЭ 2007 г., ДЕМО) А15. В сосуде постоянного объема находится идеальный газ, массу которого изменяют. На
- 73. (ЕГЭ 2007 г., ДЕМО) А13. На графике (см. рисунок) представлено изменение температуры Т вещества с течением
- 74. (ЕГЭ 2008 г., ДЕМО) А10. Постоянная масса идеального газа участвует в процессе, показанном на рисунке. Наибольшее
- 75. (ЕГЭ 2008 г., ДЕМО) А11. На фотографии представлены два термометра, используемые для определения относительной влажности воздуха.
- 76. (ЕГЭ 2008 г., ДЕМО) А12. При постоянной температуре объём данной массы идеального газа возрос в 4
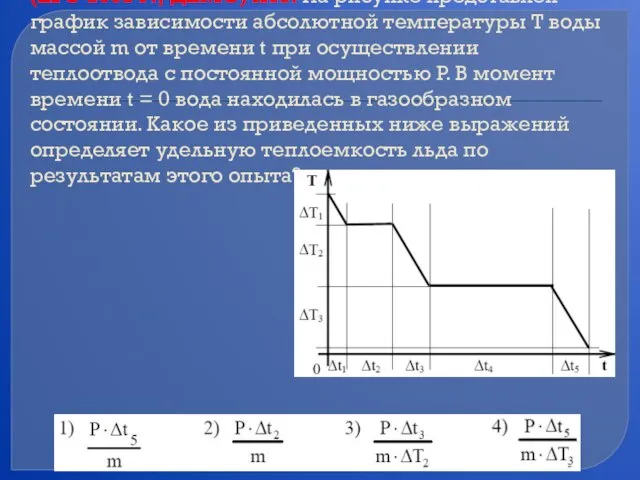
- 77. (ЕГЭ 2008 г., ДЕМО) А13. На рисунке представлен график зависимости абсолютной температуры T воды массой m
- 78. (ЕГЭ 2009 г., ДЕМО) А8. При понижении абсолютной температуры одноатомного идеального газа в 1,5 раза средняя
- 79. (ЕГЭ 2009 г., ДЕМО) А9. Горячая жидкость медленно охлаждалась в стакане. В таблице приведены результаты измерений
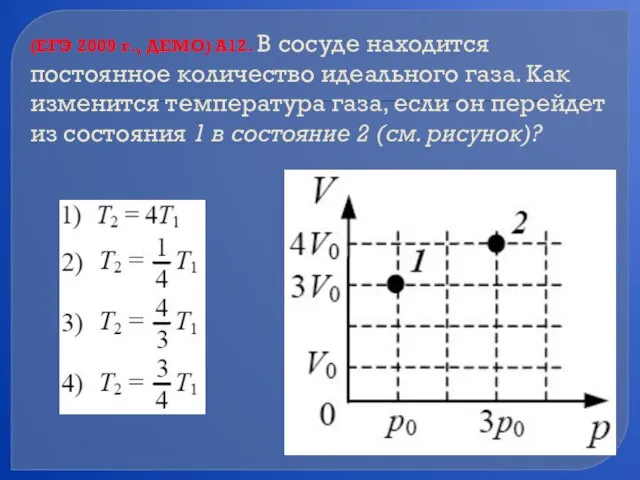
- 80. (ЕГЭ 2009 г., ДЕМО) А12. В сосуде находится постоянное количество идеального газа. Как изменится температура газа,
- 81. (ЕГЭ 2009 г., ДЕМО) В2. Используя первый закон термодинамики, установите соответствие между описанными в первом столбце
- 82. (ЕГЭ 2010 г., ДЕМО) А9. На рисунке приведены графики зависимости давления 1 моль идеального газа от
- 83. (ЕГЭ 2010 г., ДЕМО) А8. В результате нагревания неона абсолютная температура газа увеличилась в 4 раза.
- 84. (ЕГЭ 2010 г., ДЕМО) В1. В сосуде неизменного объема находилась при комнатной температуре смесь двух идеальных
- 86. Скачать презентацию






























































 Тормозное управление
Тормозное управление Петля КМПЦ
Петля КМПЦ Векторная физическая величина сила
Векторная физическая величина сила Занимательная физика. Задачи
Занимательная физика. Задачи Проектирование зоны ТО-2 для парка автомобилей Volvo FM 6730
Проектирование зоны ТО-2 для парка автомобилей Volvo FM 6730 Магнитное взаимодействие
Магнитное взаимодействие Постоянные магниты
Постоянные магниты Дви́гатель вну́треннего сгора́ния (ДВС)
Дви́гатель вну́треннего сгора́ния (ДВС) Глубокая яма
Глубокая яма ОМиУОИ_л1
ОМиУОИ_л1 Презентация на тему Шкала электромагнитных волн
Презентация на тему Шкала электромагнитных волн  Физика вокруг нас Подготовили: обучающиеся 10 класса
Физика вокруг нас Подготовили: обучающиеся 10 класса Технология обработки на металлорежущих станках. Элементы резьбы
Технология обработки на металлорежущих станках. Элементы резьбы Балочные системы. Определение реакций опор. (Тема 1.4.1)
Балочные системы. Определение реакций опор. (Тема 1.4.1) Техническое обслуживание и ремонт электрических машин постоянного и переменного тока. Тест
Техническое обслуживание и ремонт электрических машин постоянного и переменного тока. Тест Логические элементы
Логические элементы Основные законы электрической цепи постоянного тока
Основные законы электрической цепи постоянного тока Применение зондовых методов для локальной модификации поверхности
Применение зондовых методов для локальной модификации поверхности Метод электрон-стимулированного комбинационного Рассеяния (electron-enhanced Raman scattering, EERS)
Метод электрон-стимулированного комбинационного Рассеяния (electron-enhanced Raman scattering, EERS) Принципы радиосвязи
Принципы радиосвязи Электромагнетизм
Электромагнетизм Модель атома Томсона
Модель атома Томсона Центр тяжести тел. Условия равновесия тел
Центр тяжести тел. Условия равновесия тел Плоская система пар сил и условие её равновесия
Плоская система пар сил и условие её равновесия Диффузия газов 2.2.1
Диффузия газов 2.2.1 Презентация на тему Магнитное поле катушки с током. Электромагниты
Презентация на тему Магнитное поле катушки с током. Электромагниты  Механические передачи. Цепные передачи. (Лекция 3)
Механические передачи. Цепные передачи. (Лекция 3) Управляющие процессы и их формализованное описание
Управляющие процессы и их формализованное описание