Содержание
- 2. 1891 год Ирландский физик Стони вел понятие ЭЛЕКТРОН (по-гречески «янтарь») – частица, которая переносит электричество. Английский
- 3. 1897 год ДЖ. Томсон предложил модель атома – «Пудинг с изюмом» электрон +
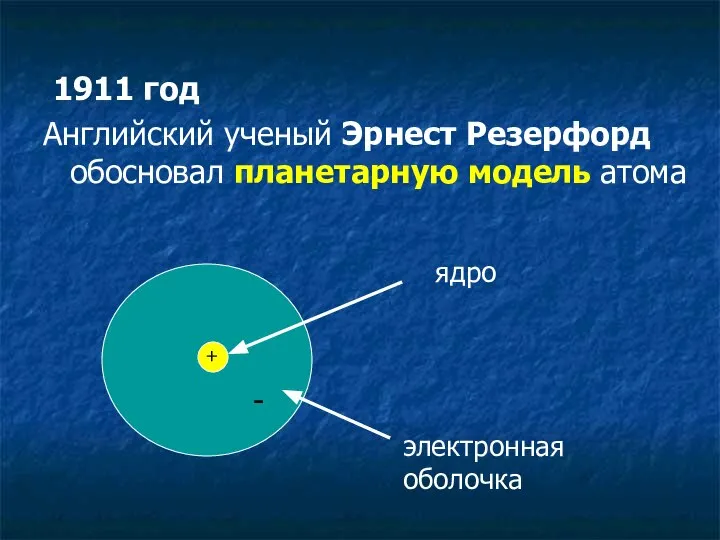
- 4. 1911 год Английский ученый Эрнест Резерфорд обосновал планетарную модель атома + ядро электронная оболочка -
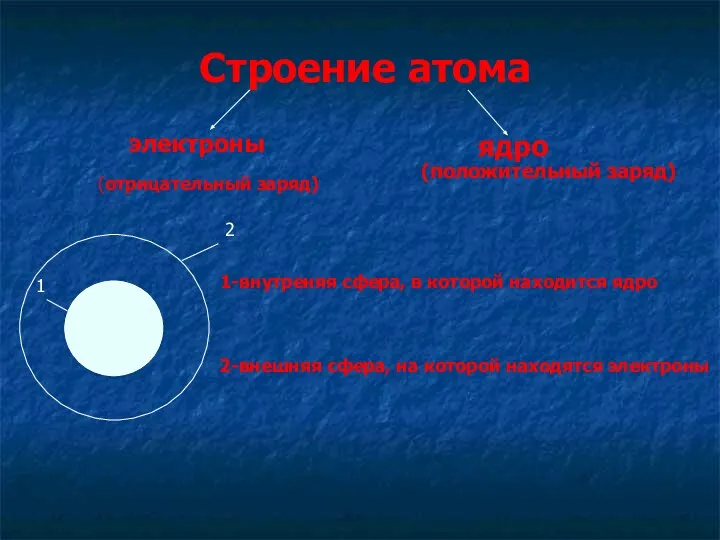
- 5. Строение атома электроны ядро 1-внутреняя сфера, в которой находится ядро 2-внешняя сфера, на которой находятся электроны
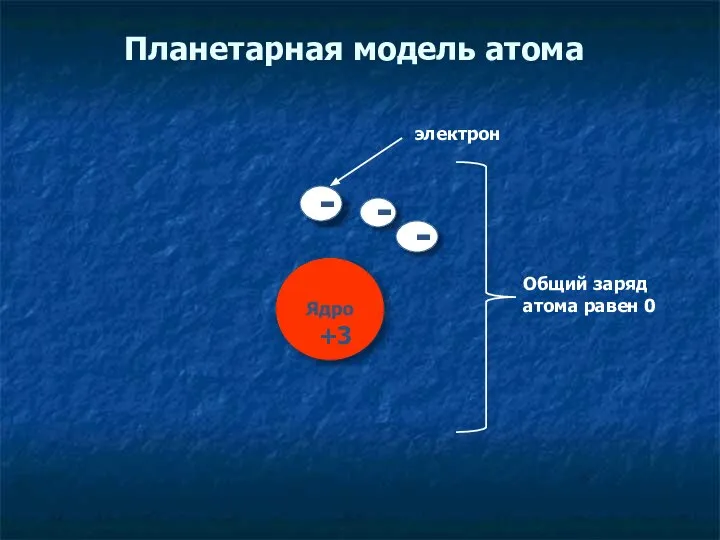
- 6. Планетарная модель атома электрон + Общий заряд атома равен 0 - 3 - -
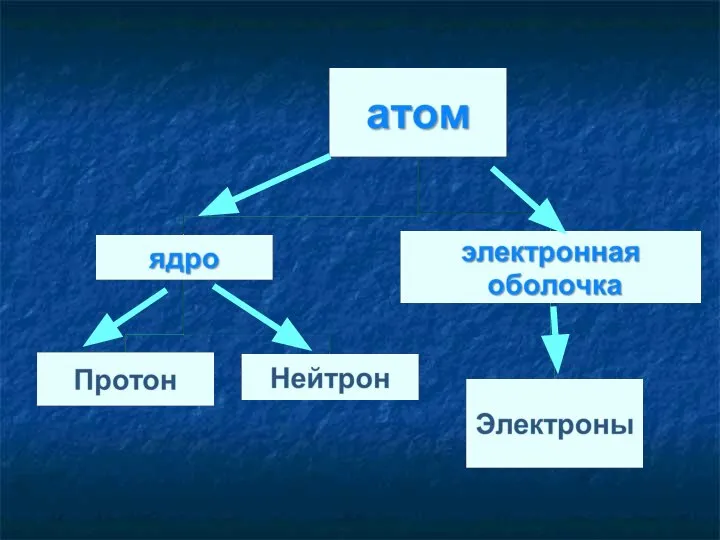
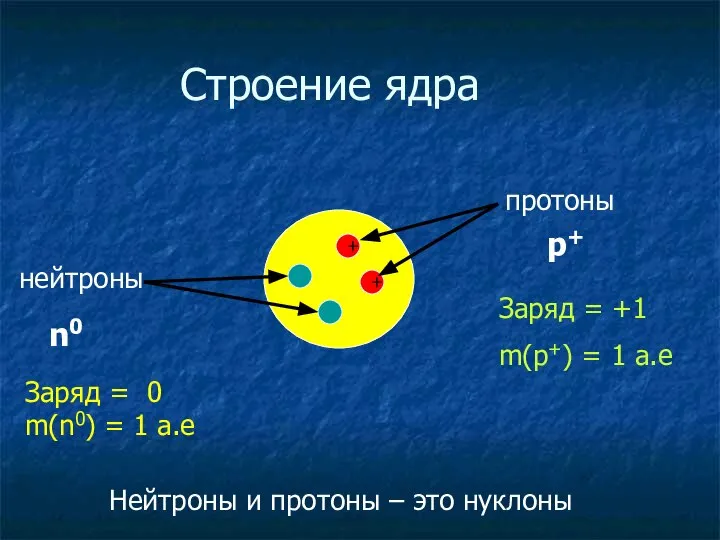
- 8. + + Строение ядра протоны нейтроны n0 p+ Заряд = +1 m(p+) = 1 a.e Заряд
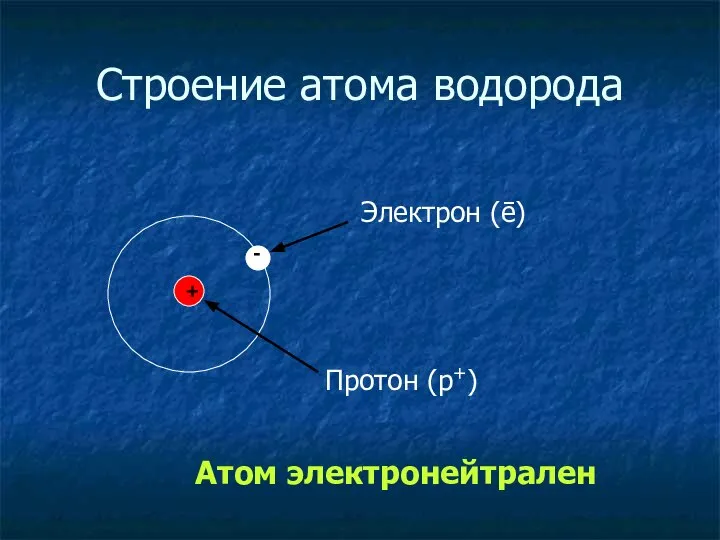
- 9. Строение атома водорода + - Протон (p+) Электрон (ē) Атом электронейтрален
- 10. Современная модель атома Атом – электронейтральная частица Ядро атома – положительно заряженное Электроны – отрицательно заряженные
- 11. Число протонов = заряду атомного ядра = числу электронов = = порядковому номеру элемента Mg 12
- 12. Состав ядра атома Протоны. Масса = 1, заряд = +1 Нейтроны. Масса = 1, заряд =
- 13. Масса атома – это масса его ядра. Число протонов + число нейтронов = массовое число (А)
- 14. Задание Укажите состав атома натрия Na 11 23 p+ = 11 ē = 11 n0 =
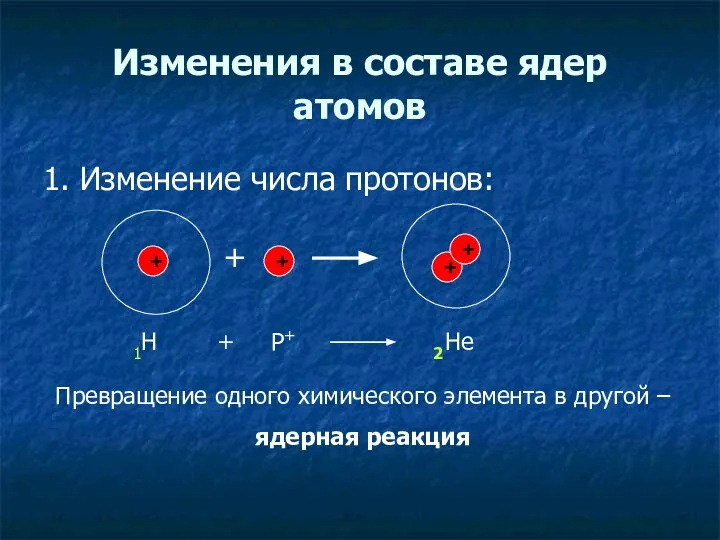
- 15. Изменения в составе ядер атомов 1. Изменение числа протонов: + + + + + 1Н Р+
- 16. Химический элемент – это вид атомов с одинаковым зарядом ядра (с одинаковым числом протонов в ядре)
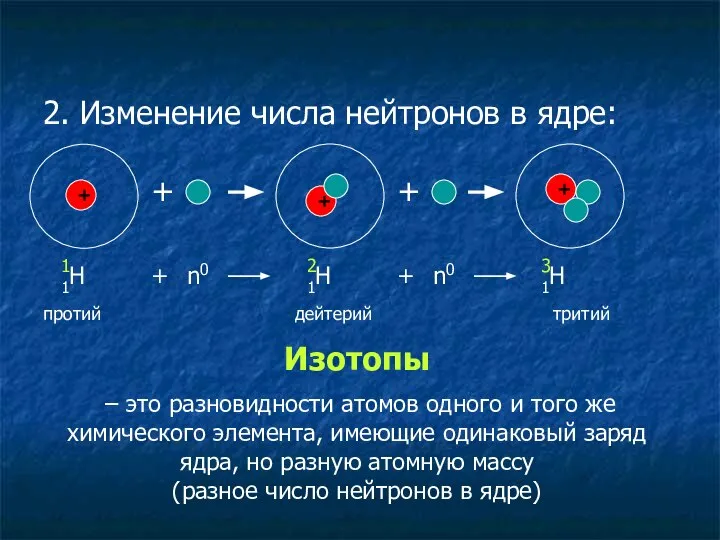
- 17. 2. Изменение числа нейтронов в ядре: + 1Н + + + + 1 + n0 1Н
- 18. 17 Сl 35 17 Сl 37 75% 25% Ar = 0.75 * 35 + 0.25 *
- 20. Скачать презентацию









 Механическое движение. Положение тела в пространстве
Механическое движение. Положение тела в пространстве Механические колебания
Механические колебания opredelenie_koordinaty_dvizh_tela
opredelenie_koordinaty_dvizh_tela Применение скакалки, каната на занятиях физической культуры и внеурочной деятельности
Применение скакалки, каната на занятиях физической культуры и внеурочной деятельности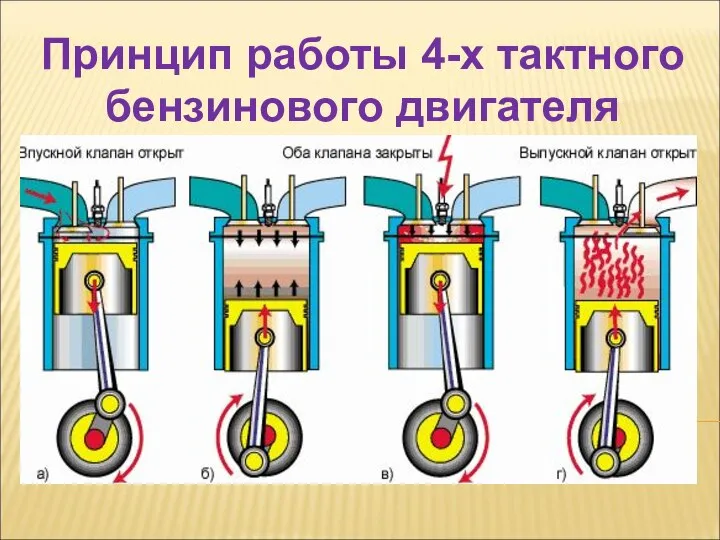 Принцип работы 4-х тактного бензинового двигателя
Принцип работы 4-х тактного бензинового двигателя Оптическое излучение
Оптическое излучение Сравнение количеств теплоты при смешивании воды разной температуры. Лабораторная работа № 1
Сравнение количеств теплоты при смешивании воды разной температуры. Лабораторная работа № 1 Обратимые и необратимые термодинамические процессы. (Лекция 8)
Обратимые и необратимые термодинамические процессы. (Лекция 8) Зависимость давления твердых тел от силы давления и от площади поверхности, на которую действует сила давления
Зависимость давления твердых тел от силы давления и от площади поверхности, на которую действует сила давления Винтовые конвейеры
Винтовые конвейеры Презентация на тему Ядерная модель атома.Квантовые постулаты Бора
Презентация на тему Ядерная модель атома.Квантовые постулаты Бора  Такелажные работы с тросами
Такелажные работы с тросами Устройство и принцип работы дизельного двигателя
Устройство и принцип работы дизельного двигателя Энергия. Виды энергии
Энергия. Виды энергии Время и его измерение. Основы кинематики
Время и его измерение. Основы кинематики Принцип работы 4-х тактного дизельного двигателя
Принцип работы 4-х тактного дизельного двигателя Измерение скоростей молекул газа. Опыт Штерна
Измерение скоростей молекул газа. Опыт Штерна Extended Defects in c-Si
Extended Defects in c-Si Световые явления. 8 класс
Световые явления. 8 класс Термодинамические законы
Термодинамические законы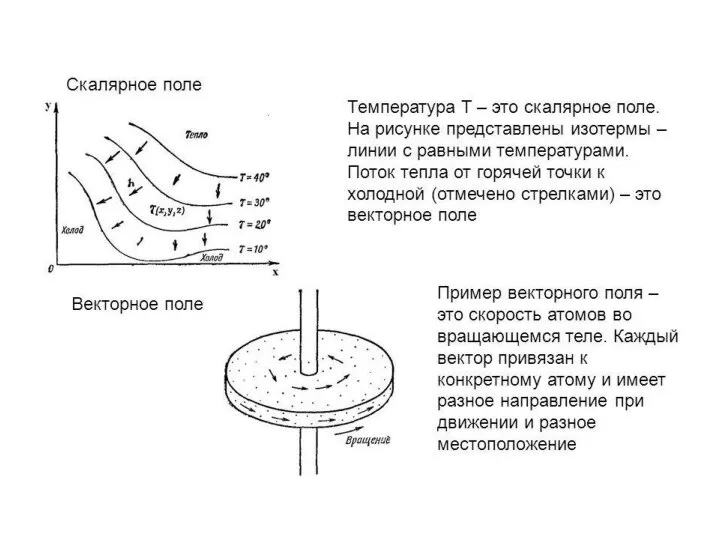 Скалярное поле. Векторное поле
Скалярное поле. Векторное поле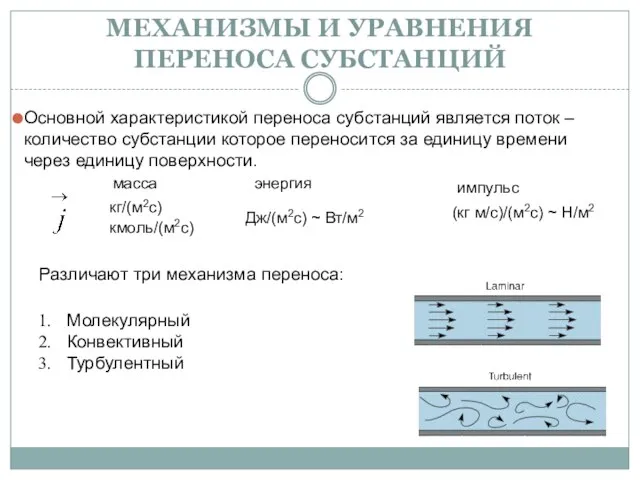 Механизмы и уравнения переноса субстанций
Механизмы и уравнения переноса субстанций Контакт волнистых и шероховатых тел
Контакт волнистых и шероховатых тел 13 июня - День швейной машинки
13 июня - День швейной машинки Надёжность электрических машин. Надёжность контактных колец и подшипниковых узлов электрических машин
Надёжность электрических машин. Надёжность контактных колец и подшипниковых узлов электрических машин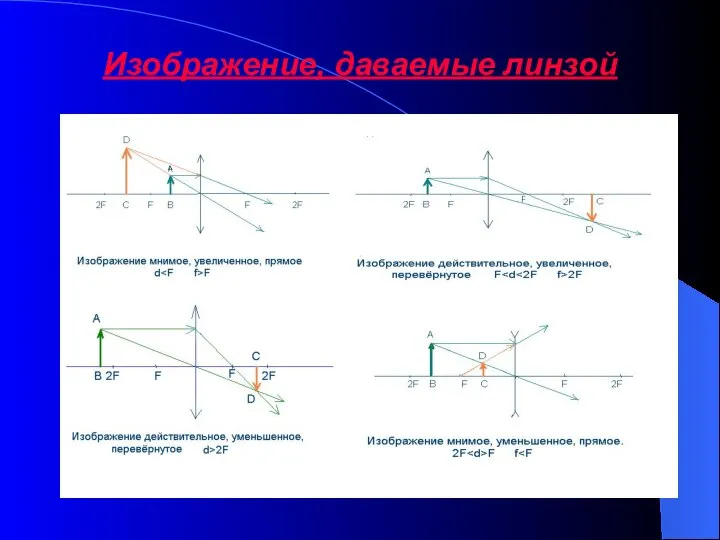 Изображение, даваемые линзой
Изображение, даваемые линзой Свободные и вынужденные колебания. Колебательные системы. (9 класс)
Свободные и вынужденные колебания. Колебательные системы. (9 класс) Плоские и сферические зеркала
Плоские и сферические зеркала