Содержание
- 2. Гипотеза о том, что вещества состоят из большого числа атомов, зародилась свыше двух тысячелетий назад. Позиция
- 3. Конкретные представления о строении атома развивались по мере накопления физикой фактов о свойствах вещества 1887г. -
- 4. Сэр Джо́зеф Джон То́мсон (1856 - 1940) — английский физик, лауреат Нобелевской премии по физике 1906
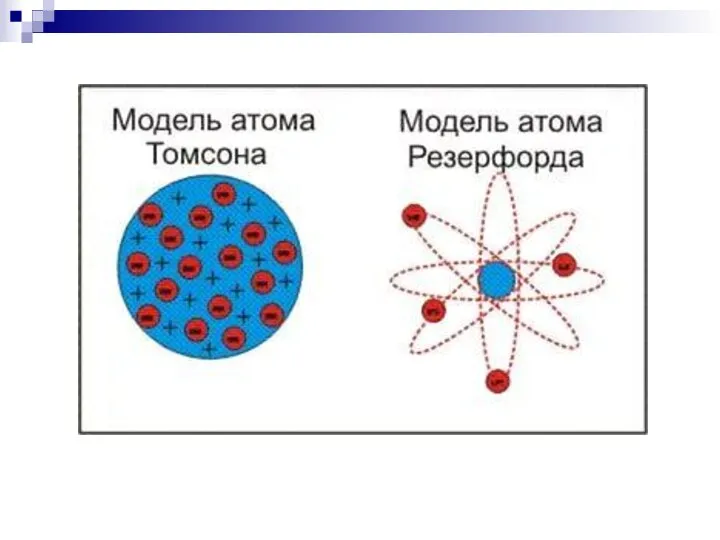
- 5. Модель строения атома Томсона Атом – шар, по всему объёму которого равномерно распределён положительный заряд. Внутри
- 6. Модель Томсона нуждалась в экспериментальной проверке. Важно было убедиться, действительно ли положительный заряд распределён по всему
- 7. Резерфорд Эрнест Резерфорд Эрнест (1871–1937) – английский физик, основоположник ядерной физики. Его исследования посвящены атомной и
- 8. Опыты Резерфорда 1906 г. Идея опыта Резерфорда: Зондировать атом альфа–частицами. Альфа-частицы возникают при распаде радия. Масса
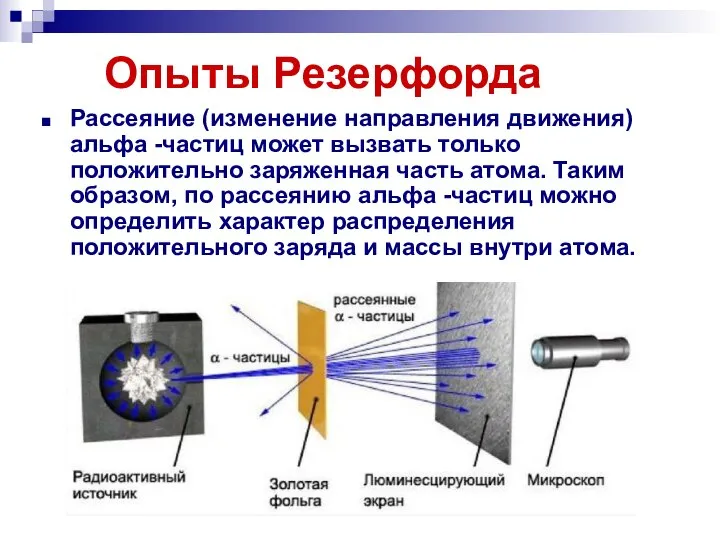
- 9. Опыты Резерфорда Рассеяние (изменение направления движения) альфа -частиц может вызвать только положительно заряженная часть атома. Таким
- 10. Опыты Резерфорда Модифицируя экспериментальную установку, Резерфорд попытался обнаружить отклонение альфа -частиц на большие углы. Для этого
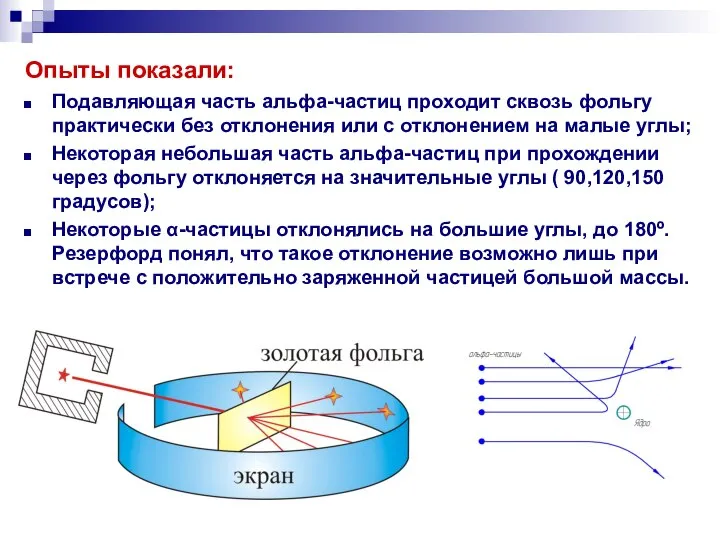
- 11. Опыты показали: Подавляющая часть альфа-частиц проходит сквозь фольгу практически без отклонения или с отклонением на малые
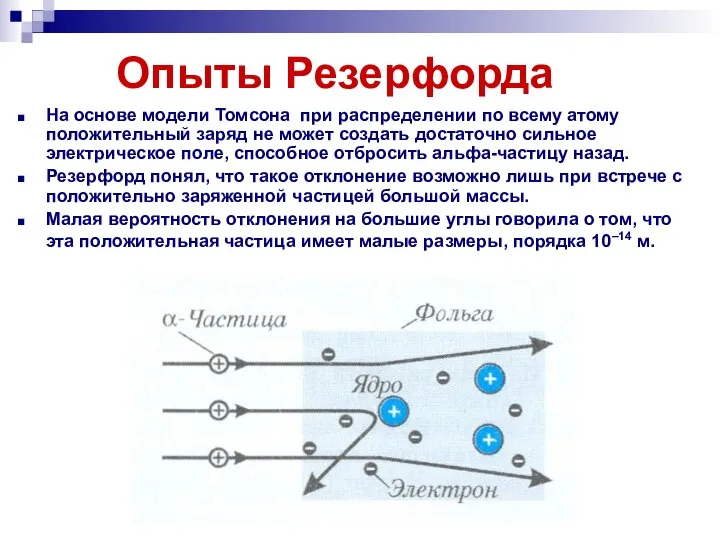
- 12. Опыты Резерфорда На основе модели Томсона при распределении по всему атому положительный заряд не может создать
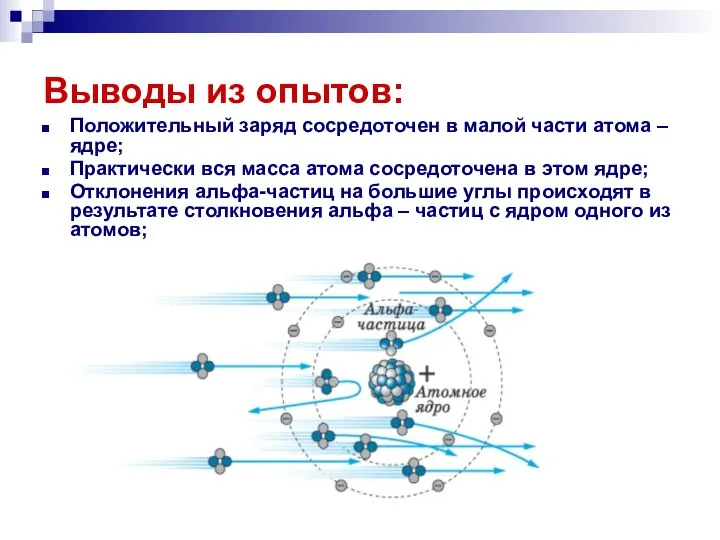
- 13. Выводы из опытов: Положительный заряд сосредоточен в малой части атома – ядре; Практически вся масса атома
- 14. Определение размеров атомного ядра Подсчитывая число альфа-частиц, рассеянных на различные углы, Резерфорд смог оценить размеры ядра.
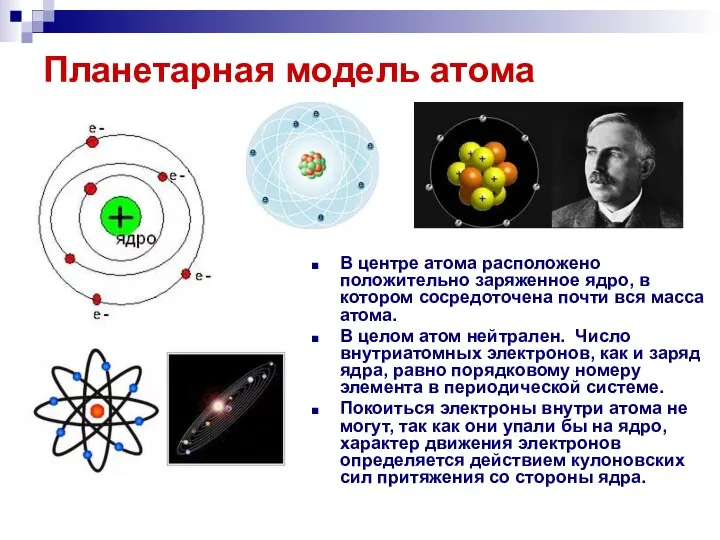
- 15. Планетарная модель атома В центре атома расположено положительно заряженное ядро, в котором сосредоточена почти вся масса
- 17. Недостатки модели атома Резерфорда Эта модель не согласуется с наблюдаемой стабильностью атомов. По законам классической электродинамики
- 18. Попыткой спасения планетарной модели атома стали постулаты Нильса Бора
- 19. Первый постулат Бора (постулат стационарных состояний) В атоме существуют стационарные состояния, в которых он не излучает
- 20. Второй постулат Бора (правило частот) При переходе электрона с одной стационарной орбиты на другую излучается (поглощается)
- 21. Границы применимости модели атома Резерфорда - Бора Следует отметить, что модель атома Резерфорда—Бора достаточно хорошо описывает
- 23. Скачать презентацию














 Как измеряются разводы и чем
Как измеряются разводы и чем Механические колебания и волны
Механические колебания и волны Презентация по физике "Путешествие в город Электризацию" -
Презентация по физике "Путешествие в город Электризацию" -  Оптоволокно. Типы оптоволокон
Оптоволокно. Типы оптоволокон Задача Эйнштейна
Задача Эйнштейна Примеры решения задач на цепи с взаимной индукцией
Примеры решения задач на цепи с взаимной индукцией Презентация на тему Закон Кулона
Презентация на тему Закон Кулона  Закон Ома для последовательной электрической цепи переменного тока, содержащей активное и реактивное сопротивления
Закон Ома для последовательной электрической цепи переменного тока, содержащей активное и реактивное сопротивления Сверхпроводимость. Эффект Мейсснера
Сверхпроводимость. Эффект Мейсснера 7 класс агрегатные состояния
7 класс агрегатные состояния Физика атома и атомного ядра
Физика атома и атомного ядра Тепловые явления
Тепловые явления Пространство, время, движение (Тема 1)
Пространство, время, движение (Тема 1) Передача мощности тепловоза ТУ10
Передача мощности тепловоза ТУ10 О пользе стекла
О пользе стекла На балу у физики
На балу у физики Устройство ракет Циолковского
Устройство ракет Циолковского Как сберечь тепло в доме
Как сберечь тепло в доме Основы химической кинетики
Основы химической кинетики Установка механической блокировки
Установка механической блокировки Строение атома Опыты Резерфорда
Строение атома Опыты Резерфорда Световой поток и световая энергия
Световой поток и световая энергия Нагревание и охлаждение воздуха
Нагревание и охлаждение воздуха النظرية الذرية الحديثة
النظرية الذرية الحديثة Магнит өрісінің. Дивергенция және Роторы
Магнит өрісінің. Дивергенция және Роторы Lk_02_PP_Klassicheskiy_metod_Tabl
Lk_02_PP_Klassicheskiy_metod_Tabl Импульс. Работа. Энергия
Импульс. Работа. Энергия Теорема Гаусса
Теорема Гаусса