Слайд 4
Основные определения и понятия
Термодинамическая система
Под понятием системы подразумевается тело

или совокупность тел .
Система называется закрытой, если она сохраняет постоянное количество вещества при всех происходящих в ней изменениях; если нет, то систему принято называть открытой.
Если между системой и окружающей ее средой нет каких-либо энергетических взаимодействий (обмен работой и теплотой), то такую систему принято называть изолированной системой.
Если отсутствует теплообмен систему называют адиабатический изолированной.
Слайд 5
Термодинамической системой принято называть закрытую систему, внутреннее состояние которой определяется значениями определенного

количества независимых переменных, которые принято называть параметрами состояния. Если состояние термодинамической системы и ее параметры не изменяются во времени, то говорят, что система находится в равновесном состоянии.
Равновесным состоянием системы называется такое тепловое, химическое, механическое состояние системы, которое может существовать сколь угодно долго при отсутствии внешнего воздействия.
Слайд 6
Простейшей термодинамической системой или простым телом называется равновесная система, физическое состояние которой

определяется значениями двух независимых переменных.
Идеальным газом называется система, физическое состояние которой определяется значением одной независимой переменной, а именно значением абсолютной температурой (T).
Слайд 7
Параметры состояния
Параметры состояния - физические величины, характеризующие внутреннее состояние термодина-мической системы.
К

простейшим термодинамическим параметрам состояния относятся: удельный объем (v), давление (p) и температура (T).
Удельный объем - это объем единицы массы вещества, а величина, обратная удельному объему, называется плотностью вещества.
Связь между параметрами, характеризующими состояние простого тела, называется уравнением состояния F (р, v, T) = 0.
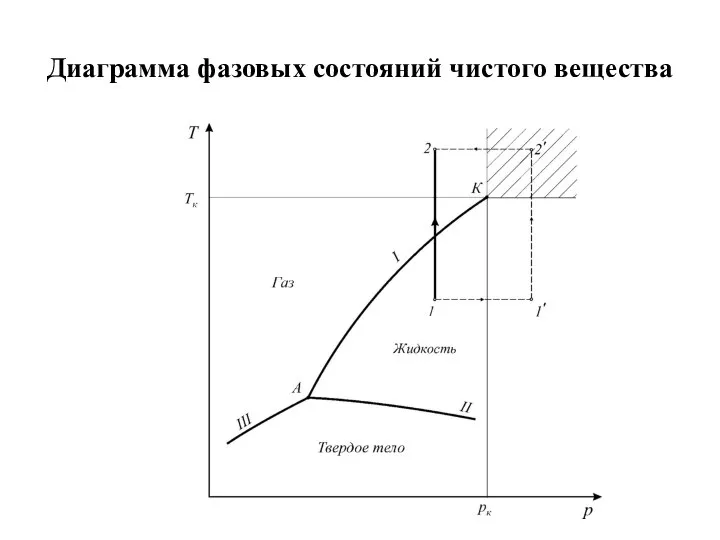
Слайд 8Диаграмма фазовых состояний чистого вещества
Слайд 9
Физическое состояние вещества
Различают три агрегатных состояния простых систем: твердое, жидкое и

газовое.
Линии фазовых превращений (испарение - I, плавление - II, сублимации - III) отображают термодинамическое равновесие двухфазных систем и делят диаграмму на области различных агрегатных состояний.
Так как процессы испарения и плавления протекают при постоянной температуре, то теплоты испарения, плавления и сублимации есть теплоты изотермических превращений. Теплота фазового перехода обозначается символом r.
Слайд 10
Критическая температура – это температура, при которой и выше которой газ

никаким сжатием не может быть переведен в жидкое состояние.
Критическое давление – это такое давление, при котором и выше которого жидкость невозможно перевести в газообразное состояние никаким изменением температуры, а критический объем представляет собой максимальный объем данного количества вещества в жидком состоянии.
В закритической области ( ) вещество может находиться только в однофазном состоянии.
Слайд 11
Степень удаления от критической точки определяется с помощью приведенных параметров:
приведенного давления
приведенной

температуры
приведенного объема
Слайд 12
Уравнения состояния
Уравнения, выражающие связь между параметрами равновесного состояния термодинамической системы, называются

уравнениями состояния.
Уравнение состояния термодинамической системы, связывающее значения давления, температуры и удельного объёма рабочего тела, можно представить в виде функциональной зависимости ,
описывающее любое однофазное состояние вещества.
В термодинамических системах в качестве рабочего тела часто рассматривается идеальный газ.
Уравнение состояния идеальных газов - уравнение Клапейрона:
Слайд 13Уравнение состояния идеальных газов
для 1 кг газа
для G кг газа
для

1 кмоля газа
для кмолей газа
Слайд 16
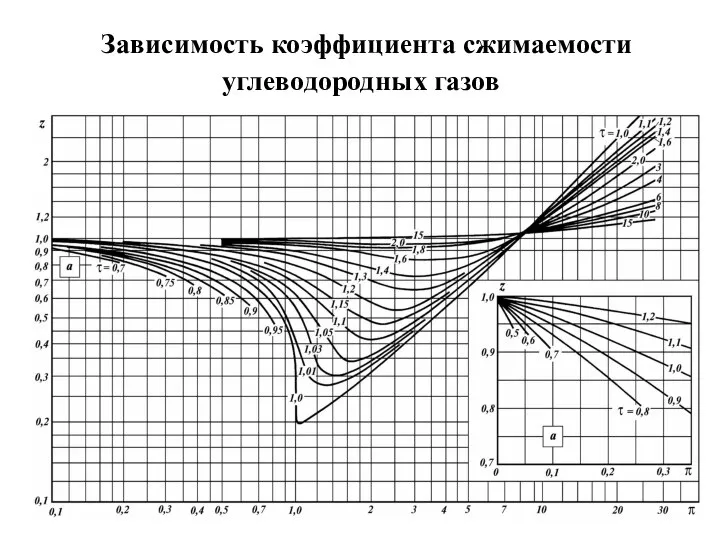
В инженерных расчетах часто пользуются уравнением состояния идеального газа с введением

в него поправочного коэффициента (z), называемого коэффициентом сжимаемости
Коэффициент сжимаемости (z) учитывает различие между идеальным и реальными газами (для идеального газа z = 1).
Слайд 17 Зависимость коэффициента сжимаемости углеводородных газов
Слайд 18Термодинамические процессы
Изменение состояния системы называется
процессом.
Равновесный процесс - это непрерывная последо-вательность равновесных

состояний системы.
Обратимым процессом называется такой равновесный процесс, который допускает возможность возврата этой системы из конечного состояния в исходное путем обратного процесса. В результате прямого и обратного обратимых процессов в системе и во внешней среде не происходит каких либо остаточных конечных изменений.
Термодинамическим процессом принято считать обратимый равновесный процесс.
Слайд 19
Термодинамическая работа
В простейшем случае элементарная термодинамическая работа L (Дж) простых тел определяется

в зависимости от величины давления и изменения объема
Удельная элементарная термодинамическая работа обратимого изменения объема (Дж/кг) определяется соотношением
Слайд 20Термодинамическая работа обратимого изменения объема
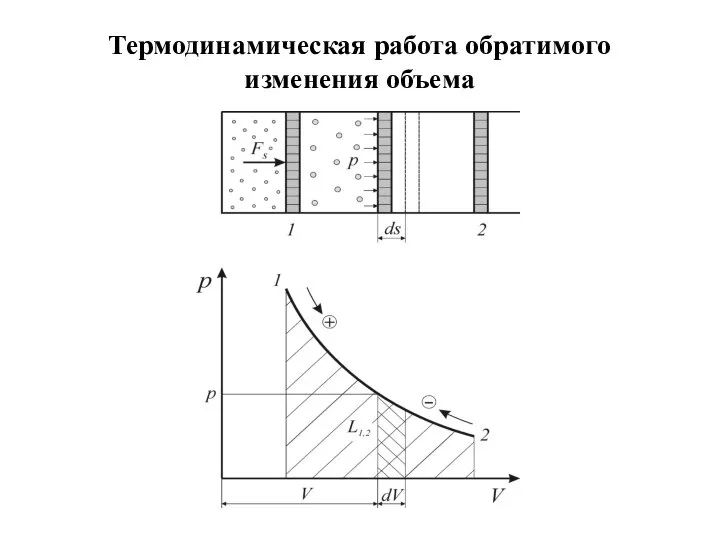
Слайд 21 Поскольку термодинамическая работа зависит от пути (вида) процесса, для вычисления интегральных значений

полной ( ), или удельной ( ) работы должны быть заданы уравнения процессов изменения состояния тела в форме , либо его графиче-ское изображение в диаграммах состояния р–V или р–v.
Как следует из рисунка термодинамическая работа определяется площадью под кривой процесса независимо от вида рабочего тела и его свойств.
В силу этого координаты р–V и р–v называются универсальными координатами работы.
Работа расширения считается положительной
( , ), а работа сжатия – отрицательной
( ).
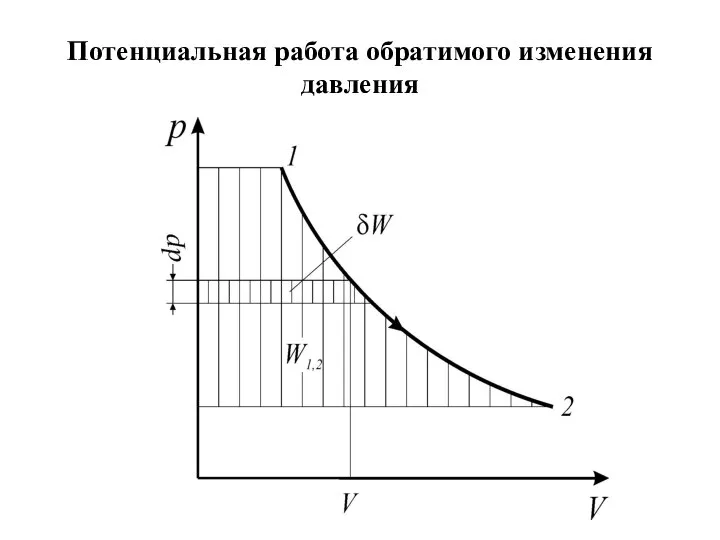
Слайд 22Потенциальная (техническая) работа
Потенциальной (технической) работой называется работа по перемещению сплошных масс (газа,

пара или жидкости) из области одного давления (p1) в область другого давления (p2 ), т.е. потенциальная работа - это работа обратимого изменения давления.
Элементарная потенциальная работа простого тела определяется из соотношения
Удельная потенциальная работа в элементарном процессе определяется по формуле
Слайд 23Потенциальная работа обратимого изменения давления
Слайд 24
Для определения интегральных значений полной
( ) или удельной ( )

работы надо знать уравнение процесса изменения состояния рабочего тела или его графическое изображение в диаграммах состояния р–V или р–v.
Как и в случае термодинамической работы, потенциальная работа определяется в координатах р–V площадью между кривой процесса и осью абсцисс независимо от вида рабочего тела и его свойств.
Слайд 25
Термодинамическая и потенциальная работы в обратимом процессе есть сумма эффективной работы

и необратимых потерь работы
Необратимые потери термодинамической ( ) и потенциальной ( ) работ превращаются в теплоту внутреннего теплообмена ( ).
Слайд 26Внутренняя энергия тела
Внутренняя энергия представляет собой полный запас энергии тела и состоит

из энергии поступатель-ного и вращательного движения молекул, энергии внутримолекулярных колебаний, потенциальной энергии сил сцепления между молекулами, внутримолекулярной энергии, внутриатомной энергии.
Внутренняя энергия U является функцией состояния, она не зависит от пути процесса, а ее элементарное изменение обозначается символом полного дифференциала (dU).
Внутренняя энергия измеряется в джоулях (Дж), а удельная внутренняя энергия (u) - в Дж/кг.
Для простых тел внутренняя энергия определяется как функция двух переменных (р,T; р,v или T,v).
Слайд 27Теплота
Теплота - количество энергии, передаваемой от одного тела к другому посредством теплопроводности,

конвективного или лучистого теплообмена. Процесс передачи теплоты называется теплообменом.
Количество теплоты , получаемое телом в результате теплообмена, зависит от вида термо-динамического процесса и аналогично работе является функцией процесса. Поэтому, элементарное количество теплоты не является полным дифференциалом ( ).
Количество теплоты измеряется в джоулях (Дж), а удельное количество теплоты
= / в Дж/кг.
Слайд 28
Теплоемкость
Истиной теплоемкостью называется количество теплоты, которое надо сообщить единице количества вещества

в термодинамическом процессе (z=idem.), чтобы его температура повысилась на 1 градус.
Различают массовую теплоемкость с, измеряемую в Дж/(кг⋅К), молярную – Дж/(кмоль⋅К) и объемную
с' – Дж/(м3⋅К).
Слайд 29
Связь между массовой, молярной и объемной теплоемкостью представлена следующими соотношениями:
Экспериментальное определение

теплоемкости обычно проводится в двух процессах: при постоянном объеме z=v=idem. (изохорная теплоемкость cv ) и постоянном давлении z=p=idem. (изобарная теплоемкость cp).
Слайд 30
Теплоемкость реального газа зависит от температуры и давления. Теплоемкость идеального газа зависит

только от температуры.
Для практических расчетов вводится понятие средней теплоемкости в интервале температур от t1 до t2, значение которой принимается неизменной для всего рассматриваемого интервала температур (сzm).
Слайд 31
Из выражения истинной теплоемкости следует, что количество теплоты, подведенной к телу (или

отведен-ной от него) в изобарном или изохорном процессе 1-2, определяется соотношением
Отсюда следует выражение средней теплоемкости газа




























 Автоматическая блокировка постоянного тока
Автоматическая блокировка постоянного тока Исследование электромагнитного загрязения города Челябинска
Исследование электромагнитного загрязения города Челябинска масс-1
масс-1 Момент силы. 7 класс
Момент силы. 7 класс Механика. Молекулярная физика
Механика. Молекулярная физика Однополярное питание в схемах на ОУ. (Лекция 6)
Однополярное питание в схемах на ОУ. (Лекция 6) Многоканальный эмиссионный спектрометр ДФС-7
Многоканальный эмиссионный спектрометр ДФС-7 Физика Лекция 2
Физика Лекция 2 Физика и техника
Физика и техника Строение атома
Строение атома Презентация без названия (1)
Презентация без названия (1) Производство,передача и использование электрической энергии
Производство,передача и использование электрической энергии Презентация на тему Оптические иллюзии или обман зрения
Презентация на тему Оптические иллюзии или обман зрения  Презентация на тему Дисперсия
Презентация на тему Дисперсия  Расчет некоторых оптических систем по теории аберраций третьих порядков
Расчет некоторых оптических систем по теории аберраций третьих порядков Введение. Тест
Введение. Тест Барометрическая формула. Распределение Больцмана
Барометрическая формула. Распределение Больцмана Кожухотрубный реактор
Кожухотрубный реактор Процесстер мен аппараттар
Процесстер мен аппараттар Ford Focus II. Задняя подвеска
Ford Focus II. Задняя подвеска Аварийные источники электрической энергии. Аккумуляторы. RAT
Аварийные источники электрической энергии. Аккумуляторы. RAT Энергия связи. Дефект масс
Энергия связи. Дефект масс Механика и элементы специальной теории относительности
Механика и элементы специальной теории относительности Строение атома
Строение атома Ионизирующие и неионизирующие излучения, их применение в лучевой диагностике и лучевой терапии
Ионизирующие и неионизирующие излучения, их применение в лучевой диагностике и лучевой терапии Атомы. Молекулы. Вещества Изотопы
Атомы. Молекулы. Вещества Изотопы Тела,вещества,частицы (1)
Тела,вещества,частицы (1) Вычисление силы тяжести
Вычисление силы тяжести