Содержание
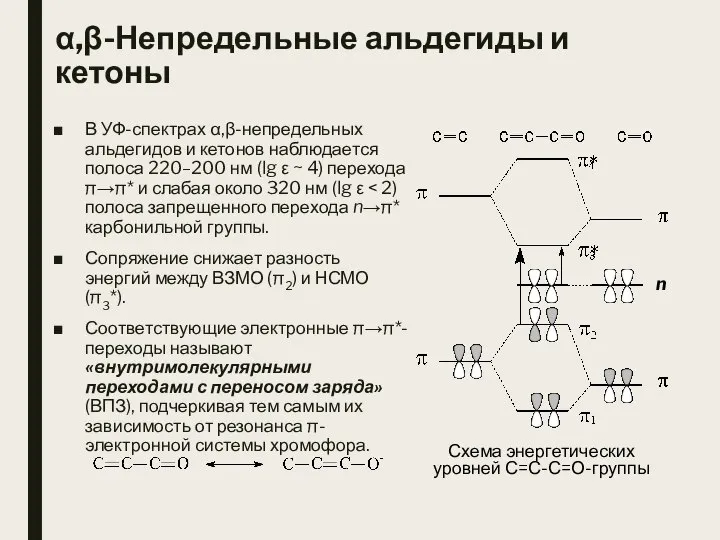
- 2. α,β-Непредельные альдегиды и кетоны В УФ-спектрах α,β-непредельных альдегидов и кетонов наблюдается полоса 220–200 нм (lg ε
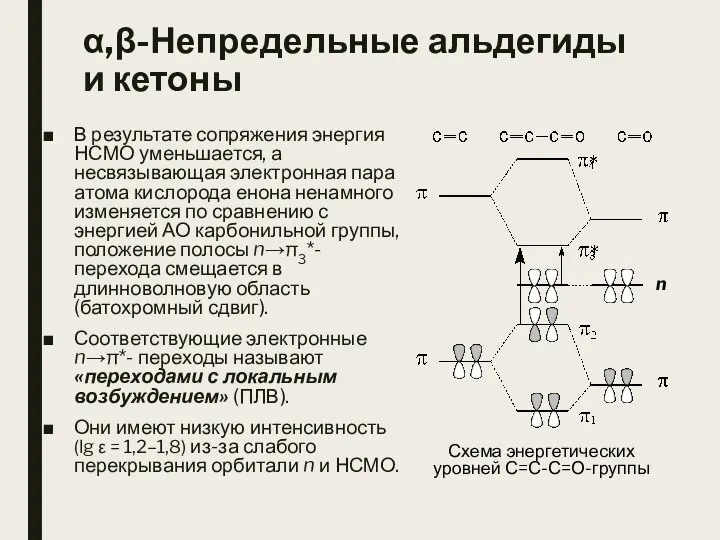
- 3. α,β-Непредельные альдегиды и кетоны В результате сопряжения энергия НСМО уменьшается, а несвязывающая электронная пара атома кислорода
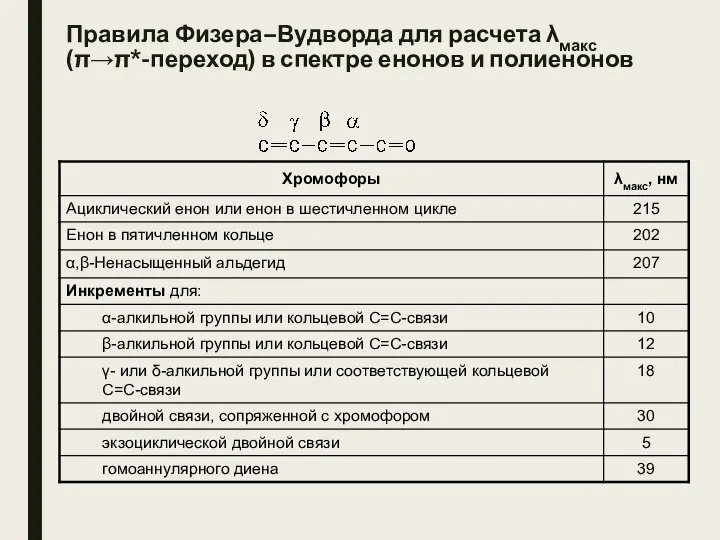
- 4. Правила Физера–Вудворда для расчета λмакс (π→π*-переход) в спектре енонов и полиенонов
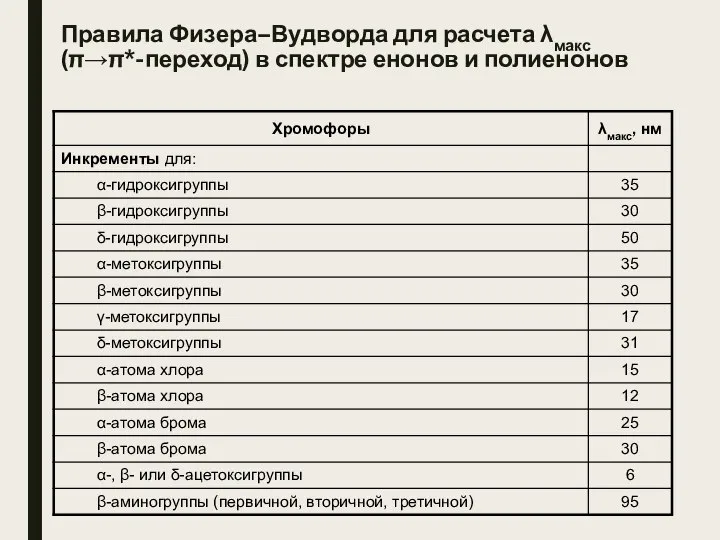
- 5. Правила Физера–Вудворда для расчета λмакс (π→π*-переход) в спектре енонов и полиенонов
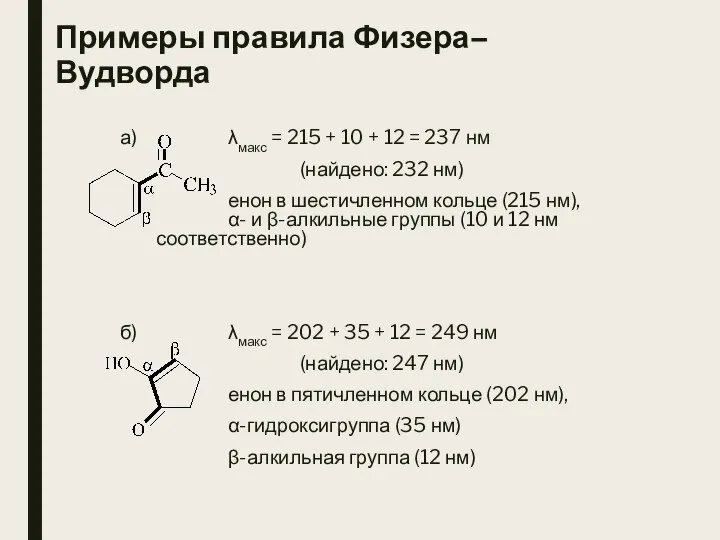
- 6. Примеры правила Физера–Вудворда а) λмакс = 215 + 10 + 12 = 237 нм (найдено: 232
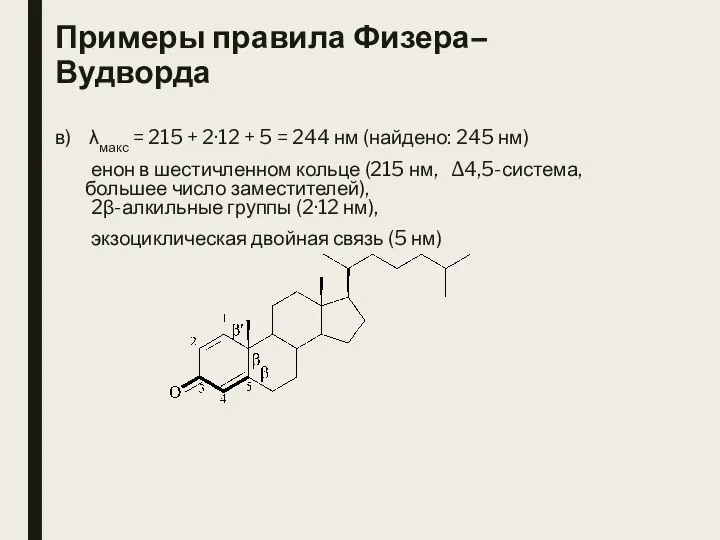
- 7. Примеры правила Физера–Вудворда в) λмакс = 215 + 2·12 + 5 = 244 нм (найдено: 245
- 8. α,β-Непредельные альдегиды и кетоны Правила Физера–Вудворда соблюдается достаточно четко для транс-конфигурации непредельной системы. Для УФ-спектров цис-систем
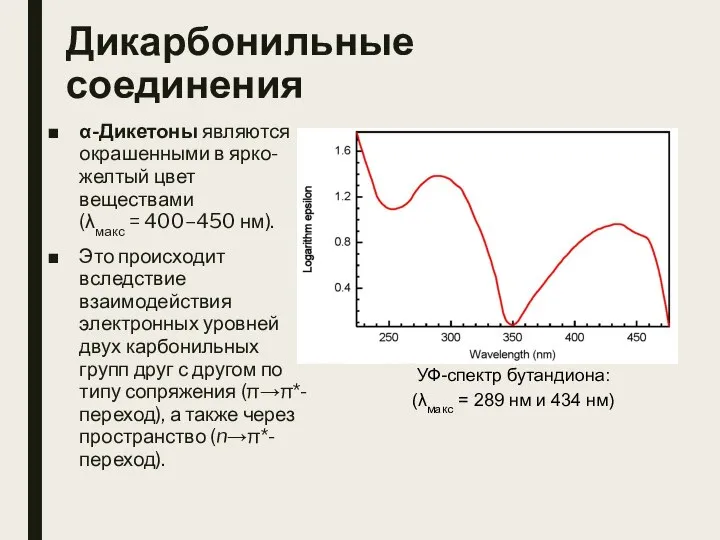
- 9. Дикарбонильные соединения α-Дикетоны являются окрашенными в ярко-желтый цвет веществами (λмакс = 400–450 нм). Это происходит вследствие
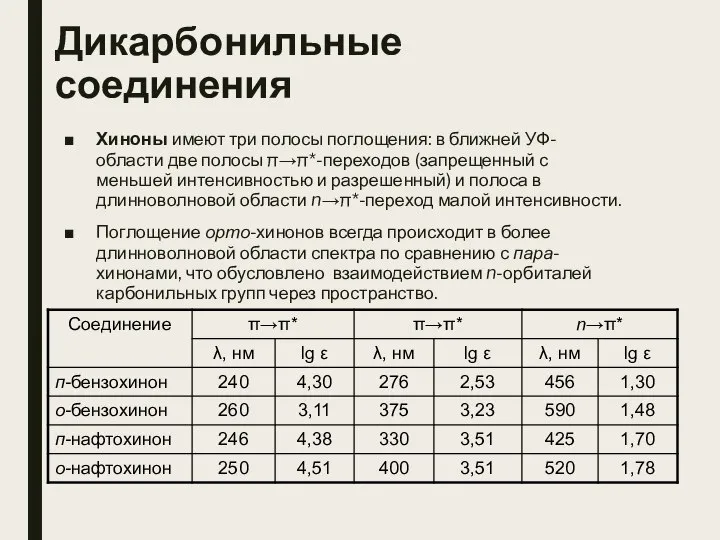
- 10. Дикарбонильные соединения Хиноны имеют три полосы поглощения: в ближней УФ-области две полосы π→π*-переходов (запрещенный с меньшей
- 11. Производные карбоновых кислот Насыщенные карбоновые кислоты в этанольных растворах имеют слабые максимумы в области 205–210 нм
- 12. α,β-Непредельные карбоновые кислоты α,β-Непредельные карбоновые кислоты имеют интенсивную полосу (lg ε ≈ 4) практически в той
- 13. Нитросоединения Нитрогруппа входит в состав нитропарафинов (R–NO2), алкилнитратов (O–NO2) и нитраминов (N–NO2). В УФ-спектрах нитросоединений наблюдается
- 14. Серосодержащие соединения Электроны атома серы менее прочно связаны с ядром, чем электроны кислорода, поэтому n→σ*-переходы в
- 15. Серосодержащие соединения Сульфоны алифатического ряда не имеют собственных полос поглощения выше 180 нм. Сульфоксиды характеризуются интенсивной
- 16. СПЕКТРЫ ПОГЛОЩЕНИЯ ОСНОВНЫХ КЛАССОВ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ Ароматические и гетероароматические соединения
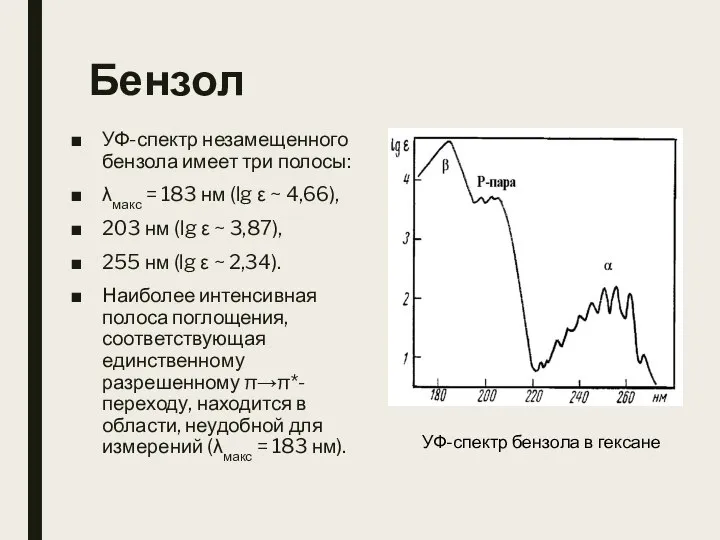
- 17. Бензол УФ-спектр незамещенного бензола имеет три полосы: λмакс = 183 нм (lg ε ~ 4,66), 203
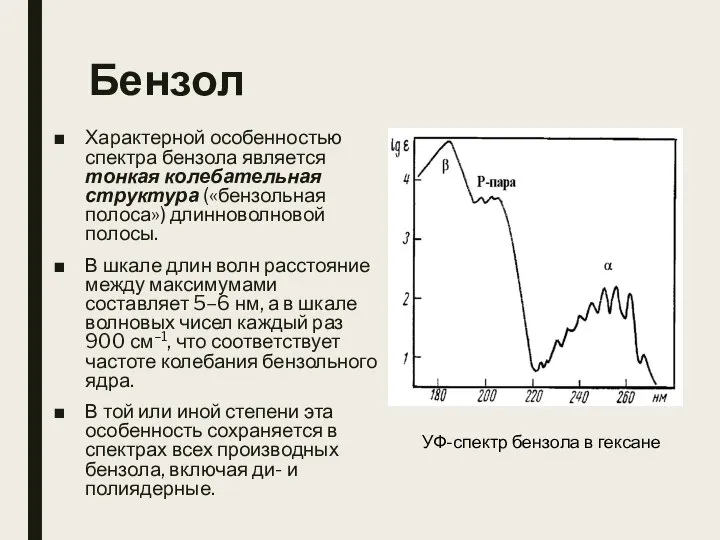
- 18. Бензол Характерной особенностью спектра бензола является тонкая колебательная структура («бензольная полоса») длинноволновой полосы. В шкале длин
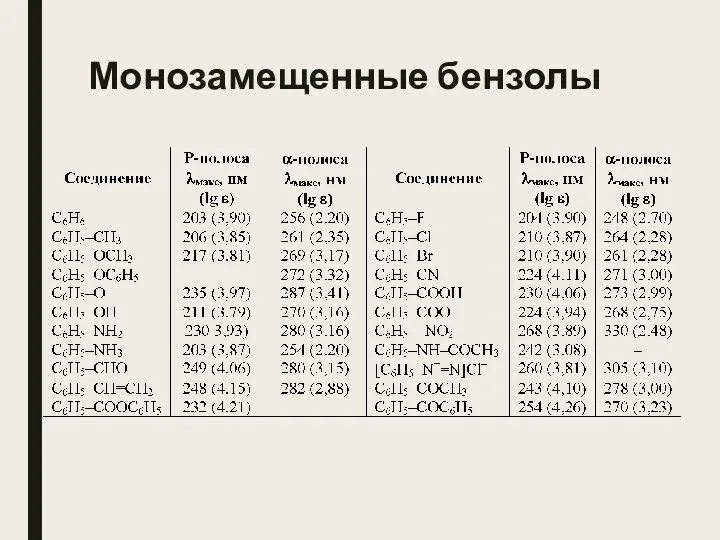
- 19. Монозамещенные бензолы
- 20. Монозамещенные бензолы Введение в бензольное ядро заместителя приводит к батохромному сдвигу максимума поглощения. Для заместителей, проявляющих
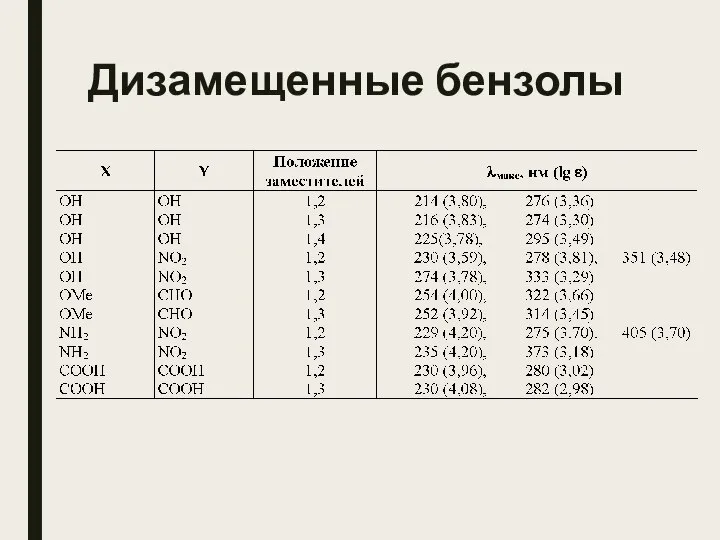
- 21. Дизамещенные бензолы
- 22. Дизамещенные бензолы Спектры 1,2- и 1,3-дизамещенных бензолов часто близки суперпозиции спектров двух соответствующих монозамещенных бензолов, а
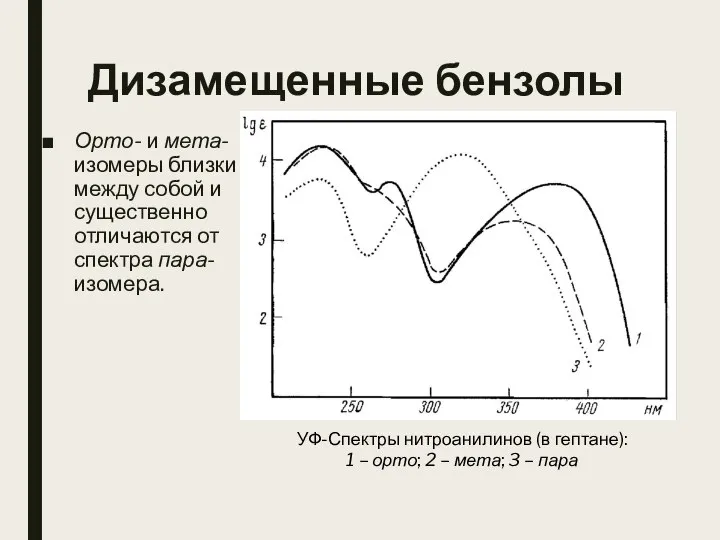
- 23. Дизамещенные бензолы Орто- и мета-изомеры близки между собой и существенно отличаются от спектра пара-изомера. УФ-Спектры нитроанилинов
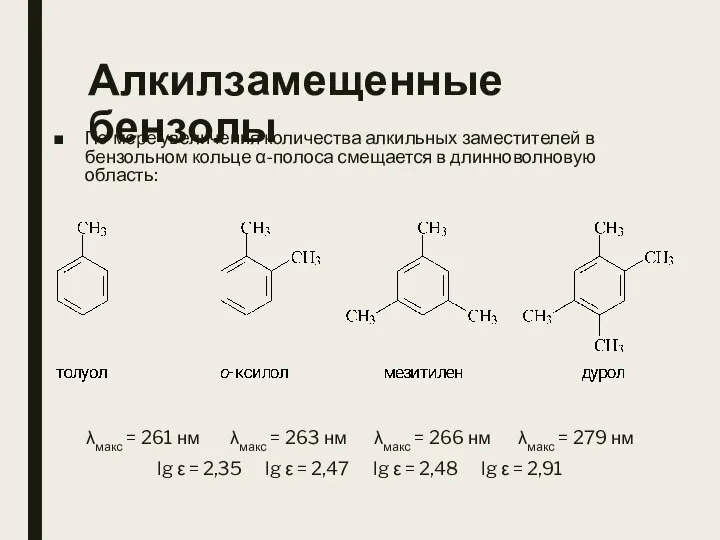
- 24. Алкилзамещенные бензолы По мере увеличения количества алкильных заместителей в бензольном кольце α-полоса смещается в длинноволновую область:
- 25. Ароматические карбонильные соединения Более надежную информацию дают электронные спектры ароматических альдегидов, кетонов, кислот и сложных эфиров,
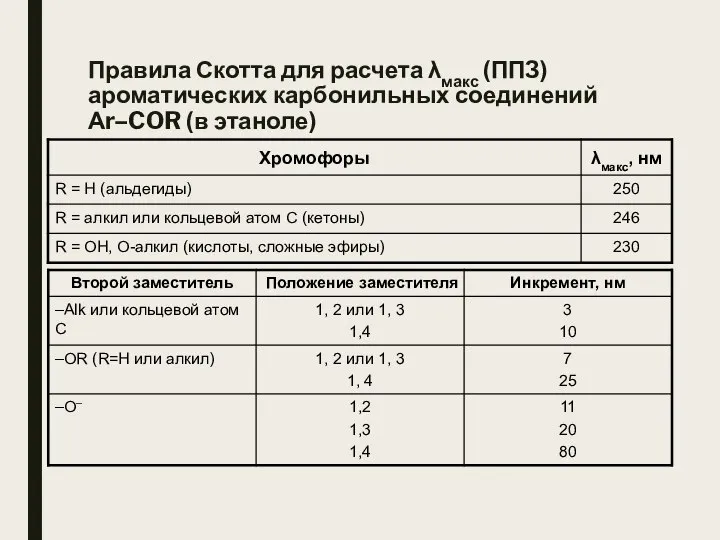
- 26. Правила Скотта для расчета λмакс (ППЗ) ароматических карбонильных соединений Аr–COR (в этаноле)
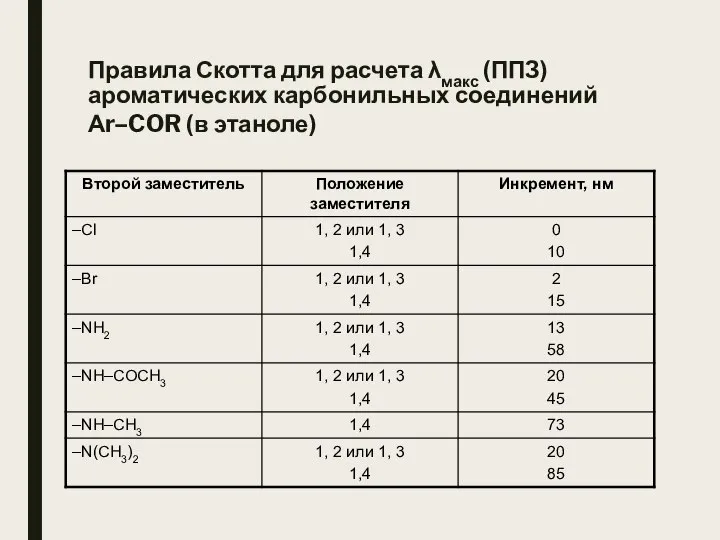
- 27. Правила Скотта для расчета λмакс (ППЗ) ароматических карбонильных соединений Аr–COR (в этаноле)
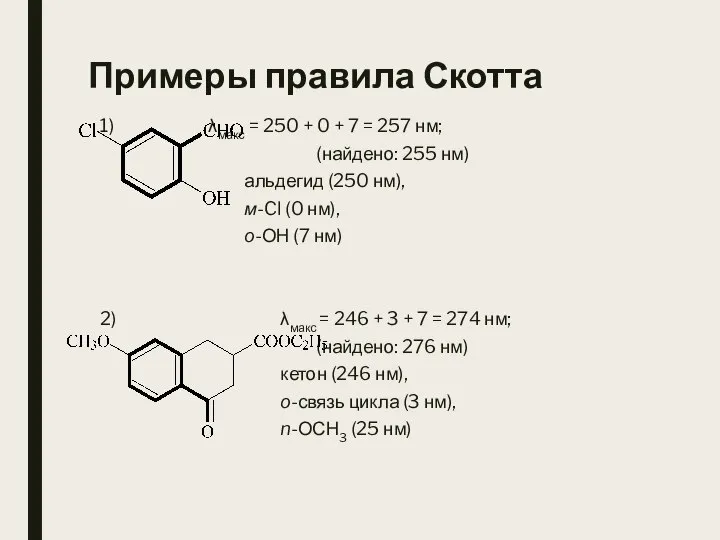
- 28. Примеры правила Скотта 1) λмакс = 250 + 0 + 7 = 257 нм; (найдено: 255
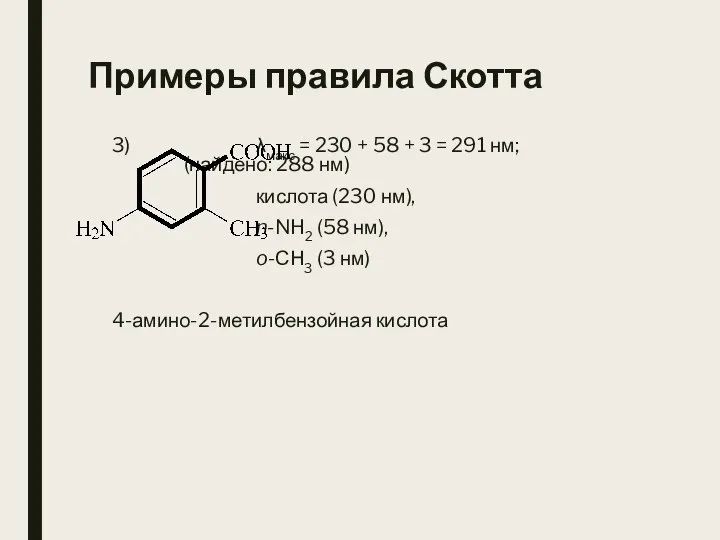
- 29. Примеры правила Скотта 3) λмакс = 230 + 58 + 3 = 291 нм; (найдено: 288
- 30. Ароматические соединения Таким образом, наличие в молекуле исследуемого соединения бензольного ядра может быть достаточно надежно установлено
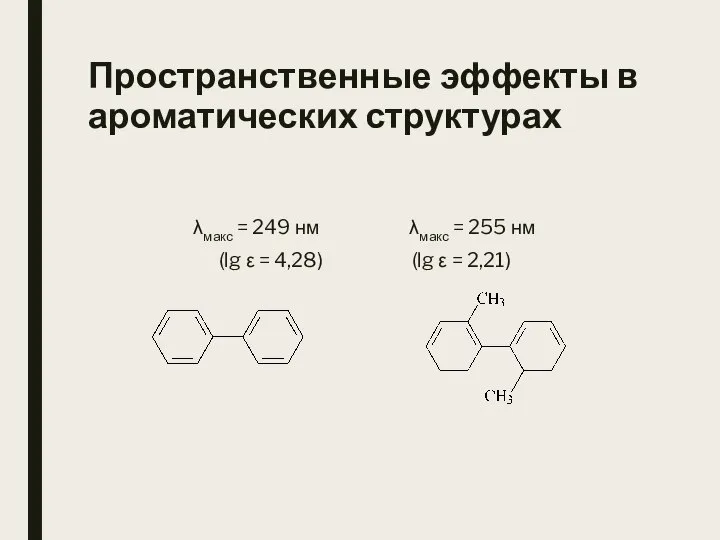
- 31. Пространственные эффекты в ароматических структурах λмакс = 249 нм λмакс = 255 нм (lg ε =
- 32. Полициклические ароматические соединения Соединения, в которых каждый атом углерода принадлежит не более чем двум кольцам, –
- 33. Полициклические ароматические соединения Все эти соединения имеют три тапа полос, различающихся по интенсивности и колебательной структуре.
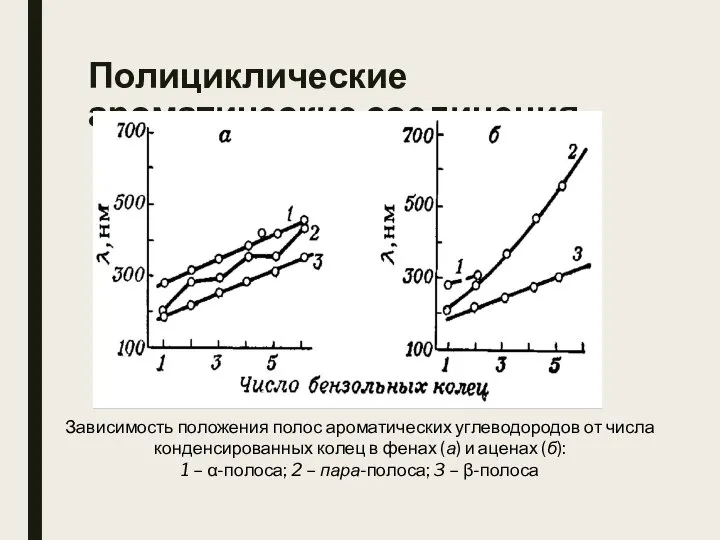
- 34. Полициклические ароматические соединения Зависимость положения полос ароматических углеводородов от числа конденсированных колец в фенах (а) и
- 35. Полициклические ароматические соединения Высокая индивидуальность спектров конденсированных ароматических соединений позволяет широко использовать их при исследовании этих
- 36. Ароматические гетероциклические соединения Подобно бензолу, ароматические гетероциклические системы в УФ-спектре имеют две полосы: интенсивную в коротковолновой
- 37. Возможности метода УФ-спектроскопии Доказательство наличия в исследуемом веществе группировок-хромофоров – сопряженной диеновой, полиеновой и ароматической систем,
- 38. Ограничения метода УФ-спектроскопии Так как многие типы органических соединений (алканы, циклоалканы, спирты, эфиры и амины предельного
- 40. Скачать презентацию

















 Правила и приёмы решения задач
Правила и приёмы решения задач Геометрическая оптика. Свет. Источники света
Геометрическая оптика. Свет. Источники света Энергия и работа. Удары. Лекция 3
Энергия и работа. Удары. Лекция 3 Матрица
Матрица Динамика. Законы Ньютона
Динамика. Законы Ньютона Презентация на тему Электрический ток в газах. Плазма
Презентация на тему Электрический ток в газах. Плазма  Лекция 4(ОИ) (студентам)
Лекция 4(ОИ) (студентам) Парабола и ее применение в жизни
Парабола и ее применение в жизни Силы трения между соприкасающимися поверхностями твердых тел
Силы трения между соприкасающимися поверхностями твердых тел Температура. Виды термометров
Температура. Виды термометров Электрическое сопротивление проводников. Единицы сопротивления. Закон Ома для участка цепи
Электрическое сопротивление проводников. Единицы сопротивления. Закон Ома для участка цепи Нефтегазовая и рудная геофизика. Сейсмические методы при изучении строения земной коры
Нефтегазовая и рудная геофизика. Сейсмические методы при изучении строения земной коры Обзор доказательств ложности утверждений о возможности самосовершенствования
Обзор доказательств ложности утверждений о возможности самосовершенствования Автомобильные субкультуры
Автомобильные субкультуры Методы измерения фокусных расстояний
Методы измерения фокусных расстояний Ускорение свободного падения на Земле и других планетах. 9 класс
Ускорение свободного падения на Земле и других планетах. 9 класс Кинематика в профессиональной деятельности
Кинематика в профессиональной деятельности Исследование радиального профиля параметров активной среды лазеров с разрядом в полом катоде
Исследование радиального профиля параметров активной среды лазеров с разрядом в полом катоде Flyer engine BYD 368
Flyer engine BYD 368 Проект Электромагнитный двигатель из батарейки
Проект Электромагнитный двигатель из батарейки Элементарные частицы
Элементарные частицы Электрический ток в металлах
Электрический ток в металлах Электромагнитные волны
Электромагнитные волны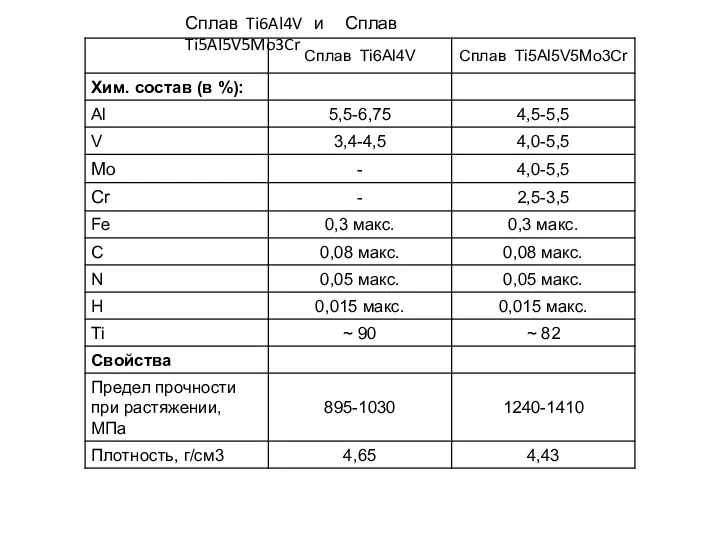 Сплав Ti6Al4V и сплав Ti5Al5V5Mo3Cr
Сплав Ti6Al4V и сплав Ti5Al5V5Mo3Cr Магнитные свойства материалов
Магнитные свойства материалов Презентация на тему Закон Паскаля
Презентация на тему Закон Паскаля  Внутренняя энергия и способы ее изменения
Внутренняя энергия и способы ее изменения Инфракрасное излучение в помощь школе
Инфракрасное излучение в помощь школе