Слайд 2Химическое равновесие является подвижным – всякое бесконечно малое внешнее воздействие на равновесную

систему вызывает бесконечно малое изменение состояния системы; по прекращении внешнего воздействия система возвращается в исходное состояние.
Слайд 3Признаки истинного химического равновесия
состояние системы остается неизменным во времени при отсутствии внешних

воздействий;
состояние системы изменяется под влиянием внешних воздействий, сколь малы бы они ни были;
состояние системы не зависит от того, с какой стороны она подходит к равновесию.
Слайд 4Положение химического равновесия – это достигнутое при равновесии соотношение концентраций реагирующих веществ,

которое неизменно для данного состояния.
Количественной характеристикой химического равновесия является константа равновесия, которая может быть выражена через равновесные концентрации С или парциальные давления P.
Слайд 5Закон действующих масс (ЗДМ)
Состояние химического равновесия описывается ЗДМ (К. Гульдберг и П.

Вааге, 1867 г.): отношение произведения равновесных молярных концентраций (или парциальных давлений) продуктов реакции, взятых в степенях, равных их стехиометрическим коэффициентам, к произведению равновесных молярных концентраций (или парциальных давлений) исходных веществ при данной температуре есть величина постоянная и называется константой химического равновесия.
Слайд 6Константа зависит только от природы реагирующих веществ и температуры. Константа, выраженная через

равновесные концентрации Ci обозначается Kс, а выраженная через парциальные давления Pi – Kр
Слайд 7Рассмотрим обратимую реакцию, в которой порядок реакции по каждому из веществ совпадает

со стехиометрическими коэффициентами:
Слайд 8Рассмотрим гомогенный процесс, где все вещества находятся в газообразном состоянии:
а(А) + b(В)

↔d(D) + k(K)
Kс = или Kр =
Равновесные молярные концентрации в литературе часто обозначаются с помощью квадратных скобок.
Слайд 9Для гетерогенного процесса
а(А) + b(В) ↔ с[C] + d(D)
Kс = или Kр
![Для гетерогенного процесса а(А) + b(В) ↔ с[C] + d(D) Kс =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1182972/slide-8.jpg)
=
Концентрация вещества С в процессе взаимодействия не изменяется, поэтому не включается в выражение константы равновесия
Слайд 10Выражение для Kс и Kр представляет собой математическое выражение закона действующих масс

применительно к обратимым процессам.
По значению константы химического равновесия можно судить о глубине протекания процесса к моменту достижения равновесия.
Если K >> 1, то числитель дроби в выражении константы равновесия во много раз превышает знаменатель, следовательно, в момент равновесия в системе преобладают продукты реакции, т.е. реакция в значительной мере протекает в прямом направлении.
Слайд 11Если K << 1, то знаменатель во много раз превышает числитель, следовательно,

в момент равновесия в системе преобладают исходные вещества, т.е. реакция лишь в незначительной степени протекает в прямом направлении.
Если K ≈ 1, то равновесные концентрации исходных веществ и продуктов реакции сопоставимы; реакция в заметной степени протекает как в прямом, так и в обратном направлении
Слайд 12Предельными значениями константы являются:
K = 0 (реакция не идет)
K = ∞ (реакция

идет до конца)
Рассмотренные условия равновесия справедливы для небольших концентраций (≤ 0,1 моль/л). Для высоких концентраций требуется внесение поправок.
Слайд 13Подставляя в уравнение Клапейрона-Менделеева РV = ⋅ RT
или РV = nRT
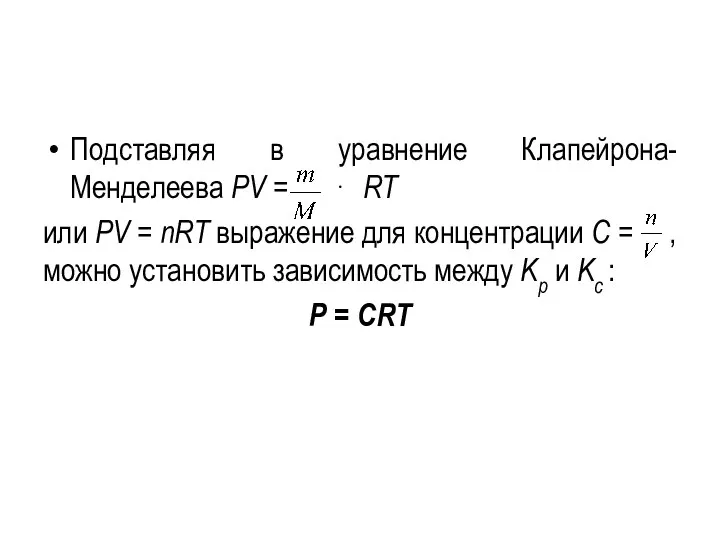
выражение для концентрации C = , можно установить зависимость между Kр и Kс :
Р = CRT
Слайд 14Р = CRT
Для реакции
а(А) + b(В) ↔ с(C) + d(D)
Kр =

Kр = Kс(RT)Δn
Δn – разность между количеством молей образовавшихся газообразных продуктов реакции и количеством молей исходных газообразных веществ
Слайд 15Равновесными называют концентрации реагирующих веществ в состоянии химического равновесия (С),
начальными (исходными)

считают заданные до начала реакции концентрации веществ (Со).
Равновесные концентрации реагентов (С) связаны с их начальной концентрацией (Со) уравнением С = Со – ΔС, где ΔС – количество исходного вещества, которое прореагировало до наступления состояния равновесия.
Для продуктов реакции С = Со + ΔС, где ΔС – количество продукта реакции, образовавшееся к наступлению состояния равновесия
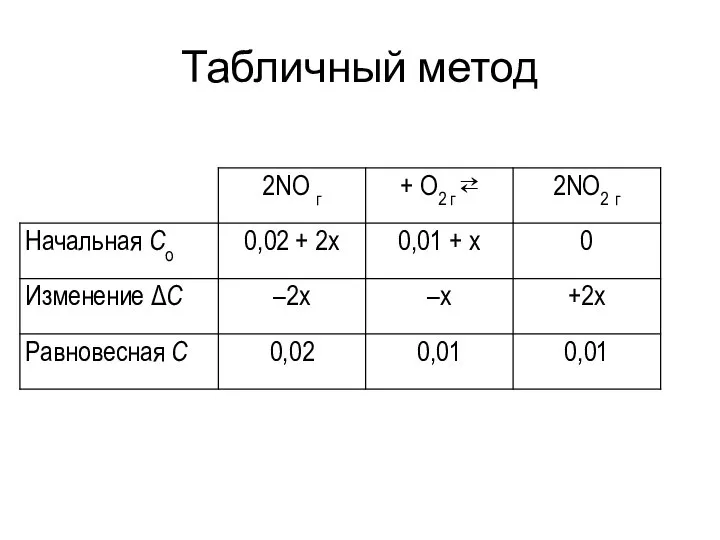
Слайд 16Пример 1.
Равновесие реакции 2(NO) + (O2) ↔ 2(NO2) установилось при следующих концентрациях

реагирующих веществ:
C(NO2) = 0,01 моль/л; С(O2) = 0,01 моль/л; С(NO) = 0,02 моль/л. Со(NO2) = 0. Вычислить константу равновесия и начальные концентрации NO и О2.
Решение. Для расчета константы химического равновесия подставим значения равновесных концентраций всех реагирующих веществ в выражение Kс:
Kс = = = 25
Слайд 17Для определения начальных концентраций каждого из веществ нужно вычислить значения ΔС.
Из

2 молей NO в результате реакции образуются 2 моля NО2, следовательно, на образование 0,01 моля NО2 к моменту установления равновесия расходовалось 0,01 моля NО.
Равновесная концентрация NO составляет 0,02 моль/л, значит, Cо (NO) = 0,02 + 0,01 = 0,03 моль/л.
Рассуждая аналогично, получим значение ΔС(О2) = 0,005 моль/л, так как по уравнению реакции 1 моль О2 расходуется при образовании 2 молей NО2.
Cо (О2 ) = 0,01 + 0,005 = 0,015 моль/л
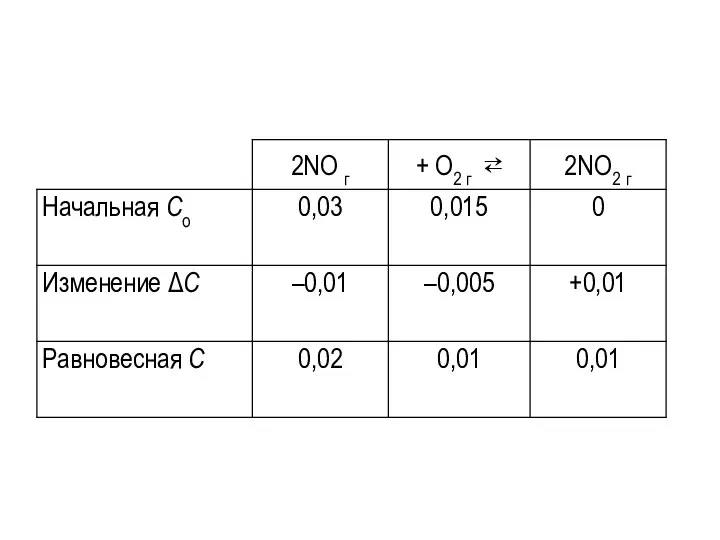
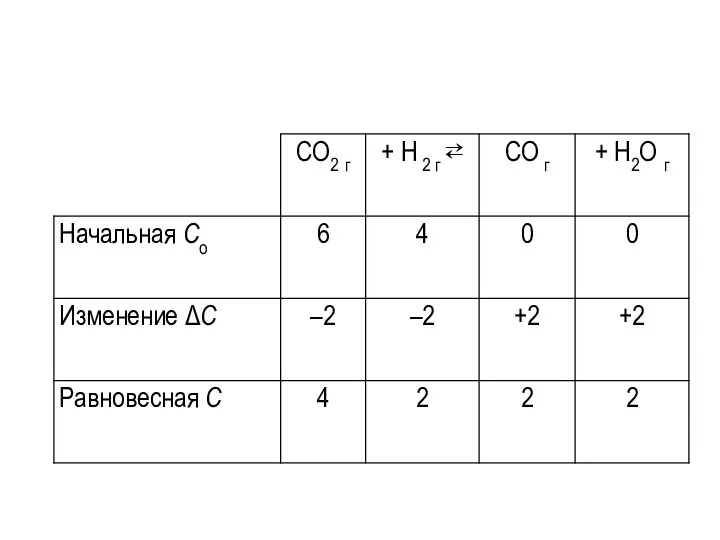
Слайд 20
Начальные концентрации оксида углерода (IV) и водорода равны соответственно 6 моль/дм3 и
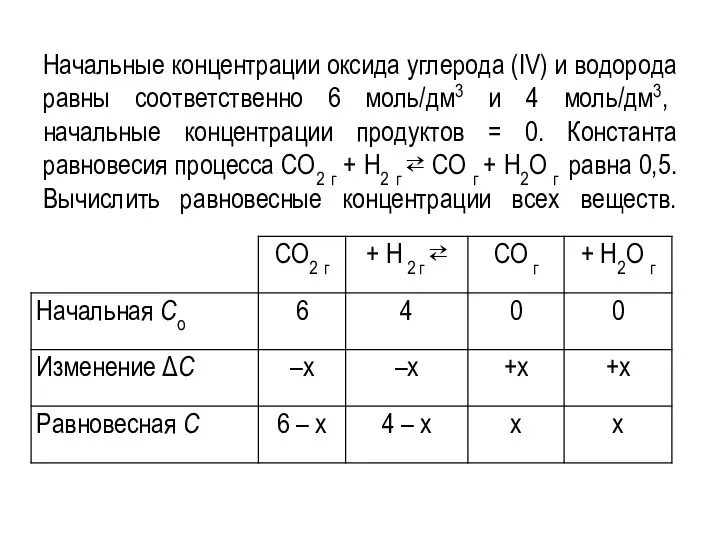
4 моль/дм3, начальные концентрации продуктов = 0. Константа равновесия процесса СО2 г + Н2 г ⇄ СО г + Н2О г равна 0,5. Вычислить равновесные концентрации всех веществ.
Слайд 21
Kс =
0,5 = , откуда х = 2 моль/дм3
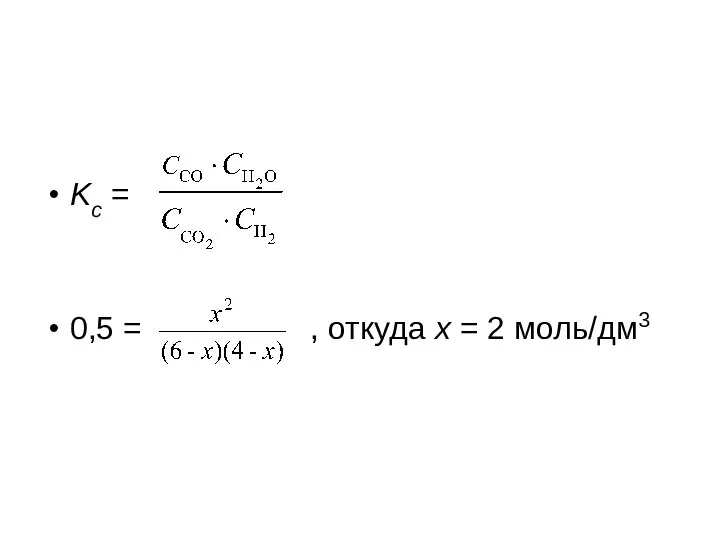
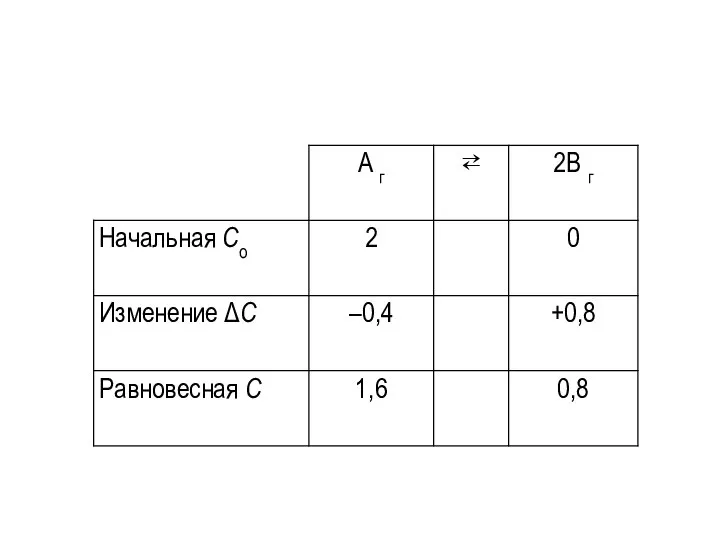
Слайд 23Пример 3. Начальная концентрация вещества А в системе
А г ⇄ 2В г
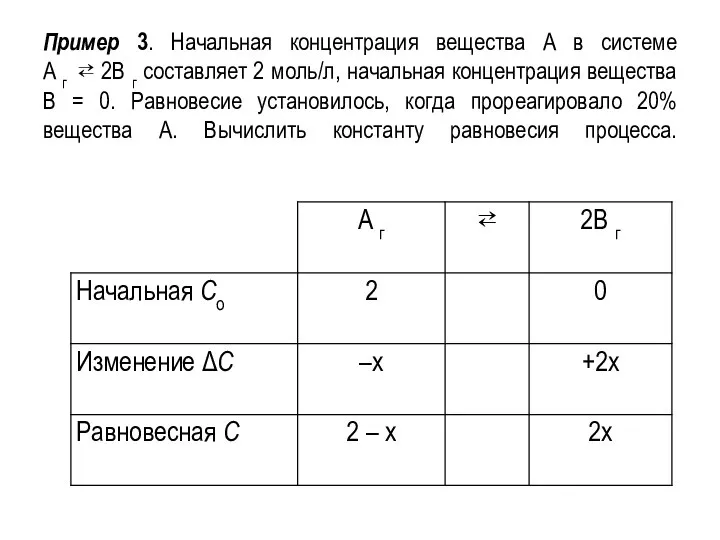
составляет 2 моль/л, начальная концентрация вещества В = 0. Равновесие установилось, когда прореагировало 20% вещества А. Вычислить константу равновесия процесса.
Слайд 24Из условия задачи следует, что количество прореагировавшего вещества А составляет 20% от

исходного количества, т. е. ΔСА = 0,2 ⋅ 2 = 0,4 моль/дм3.
Равновесная концентрация вещества А определяется как разность Со(А) – ΔСА = 2 – 0,4 = 1,6 моль/дм3.
Из 1 моль А образуются 2 моль В. Следовательно, если к моменту установления равновесия расходовано 0,4 моль/дм3 вещества А, то образовалось 0,8 моль/дм3 вещества В.
Тогда СВ = 0,8 моль/дм3







![Для гетерогенного процесса а(А) + b(В) ↔ с[C] + d(D) Kс =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1182972/slide-8.jpg)









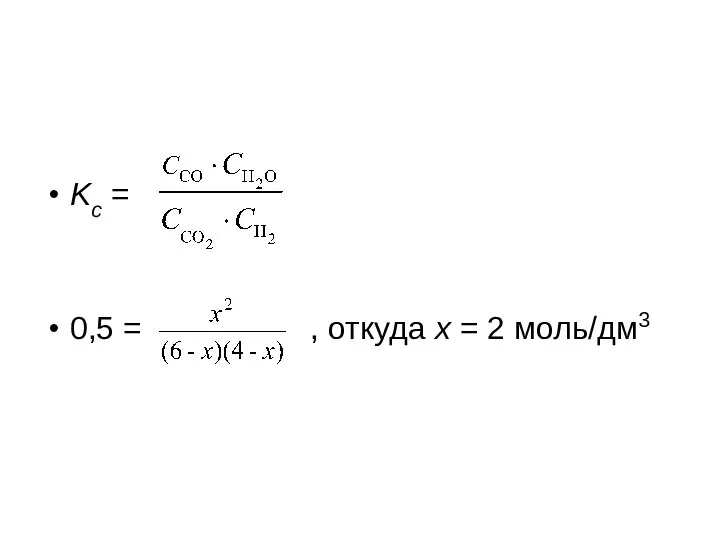


 Фотографии к исследовательской работе в рамках конкурса УРАЛХИМиЯ
Фотографии к исследовательской работе в рамках конкурса УРАЛХИМиЯ Первоначальные сведения о строение вещества
Первоначальные сведения о строение вещества Химия элементов (IБ) группы
Химия элементов (IБ) группы Презентация на тему Химия и повседневная жизнь человека
Презентация на тему Химия и повседневная жизнь человека  Использование национально-регионального компонента по химии для основной школы
Использование национально-регионального компонента по химии для основной школы Кинетика катодного выделения водорода на дисилициде хрома в щелочном и кислом электролитах
Кинетика катодного выделения водорода на дисилициде хрома в щелочном и кислом электролитах Присоединение диарилфосфинитов к а-имидоакрилатам
Присоединение диарилфосфинитов к а-имидоакрилатам Презентация на тему Знакомство с кислотами
Презентация на тему Знакомство с кислотами  Общие сведения о питании и приготовлении пищи
Общие сведения о питании и приготовлении пищи Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6]
Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6] Презентация на тему Палладий
Презентация на тему Палладий  Природа и типы химических связей
Природа и типы химических связей Этапы аналитических работ
Этапы аналитических работ Сода. Что я знаю о ней!?
Сода. Что я знаю о ней!? Предельные одноатомные спирты
Предельные одноатомные спирты Responsible Aluminium Framework
Responsible Aluminium Framework Химический анализ. Исследовательская деятельность (8 класс)
Химический анализ. Исследовательская деятельность (8 класс) ВПР – это интересно
ВПР – это интересно Технология одноступенчатого гидрокрекинга. Аппаратное оформление и основные технологические решения
Технология одноступенчатого гидрокрекинга. Аппаратное оформление и основные технологические решения Смеси: гетерогенные, гомогенные
Смеси: гетерогенные, гомогенные Моделирование деформаций углеродных слоёв при функционализации технического углерода
Моделирование деформаций углеродных слоёв при функционализации технического углерода Знатоки химии. Химия первопричина всех причин
Знатоки химии. Химия первопричина всех причин Сравнение свойств неорганических и органических веществ
Сравнение свойств неорганических и органических веществ Гальванические элементы
Гальванические элементы Алкины
Алкины Галогены - простые вещества
Галогены - простые вещества Строение атома
Строение атома Белый фосфор
Белый фосфор