Содержание
- 2. Предельные углеводороды (АЛКАНЫ) – атомы углерода соединены простыми σ связями (-С-С-С-); Непредельные углеводороды – содержат двойные
- 3. В настоящее время наиболее распространена международная (систематическая, ИЮПАК) номенклатура. Разберем ее на примере алканов. Попробуем назвать:
- 6. 3.Называют радикалы: метил, этил и т.д. (от простых к сложным, от менее разветвленным к более разветвленным).
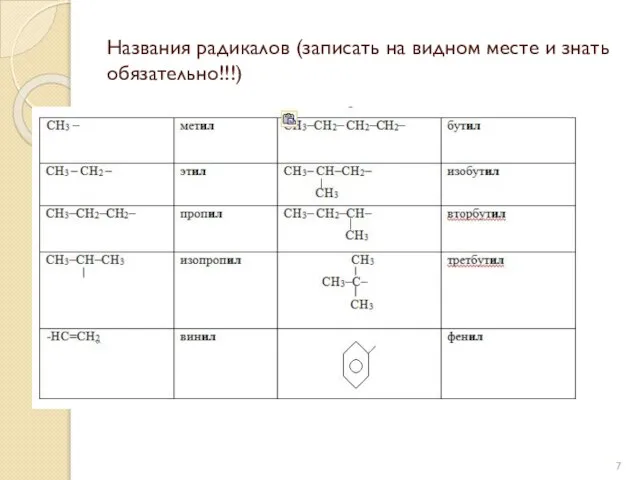
- 7. Названия радикалов (записать на видном месте и знать обязательно!!!)
- 8. 4. Перед названием радикала ставится цифра, означающая, от какого углеродного атома цепи ответвляется радикал. 5. Если
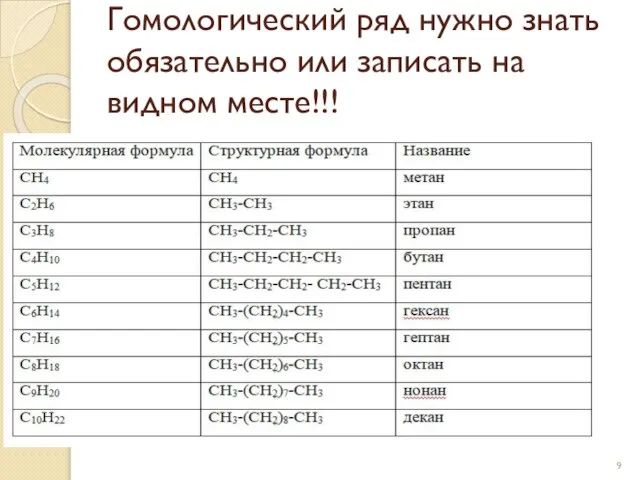
- 9. Гомологический ряд нужно знать обязательно или записать на видном месте!!!
- 10. Таким образом, данное вещество имеет название 2,4-диметилгексан.
- 11. При названии этиленовых углеводородов (алкенов) по номенклатуре ИЮПАК в качестве главной выбирают самую длинную углеродную цепь,
- 12. 3. Обозначают местоположения радикалов цифрой (цифрами), не забывая использовать приставки ди, три, тетра... и перечислять радикалы
- 13. Гомологический ряд алкенов
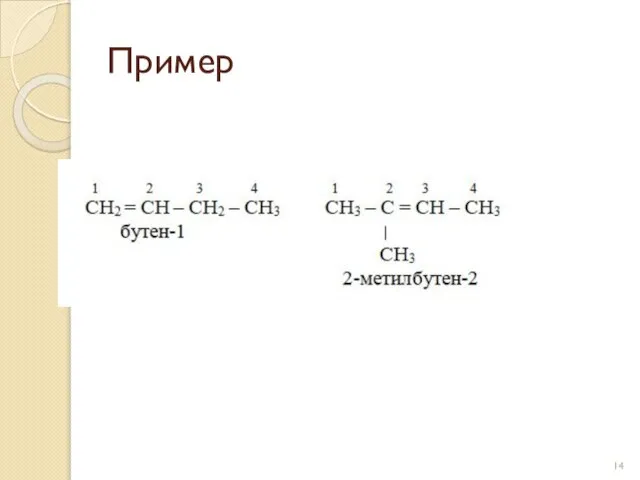
- 14. Пример
- 15. Называют ацетиленовые углеводороды так же, как и этиленовые, но вместо окончания –ен пишут –ин. После окончания
- 16. Систематическое название всех ароматических углеводородов – арены, а бензола – бензен. Гомологи бензола рассматривают, как замещённые
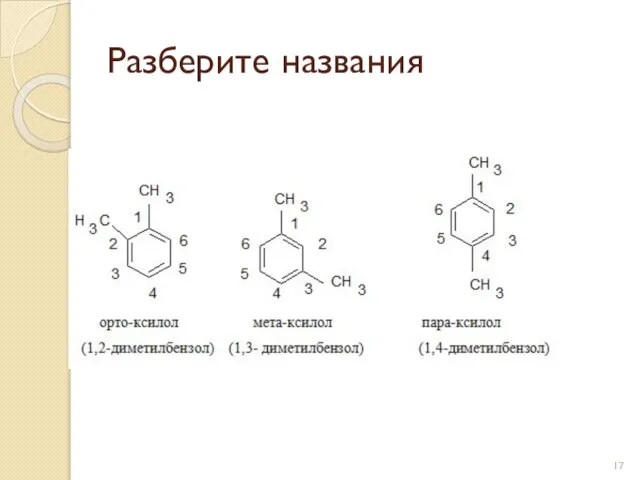
- 17. Разберите названия
- 18. Изомерия явление существования веществ, имеющих одинаковый состав (одинаковую молекулярную формулу), но разное строение (разные структурные формулы)
- 19. Изомерия алканов Для алканов характерна изомерия углеродного скелета. Для примера ниже приведены изомеры для вещества состава
- 20. Задание Попробуйте написать и назвать изомеры для алканов состава С5Н10 и С6Н14.
- 21. Изомерия алкенов Изомерия строения углеродной цепи. Положения двойной связи. Пространственная (цис- и транс- изомерия). Межклассовая изомерия.
- 22. 1. Изомерия углеродного скелета Разберем на примере С4Н8 (соответствует формуле СnH2n – это алкен) Пишем цепочку
- 23. 2.Изомеры положения двойной связи = связь может находится у любого атома углерода.
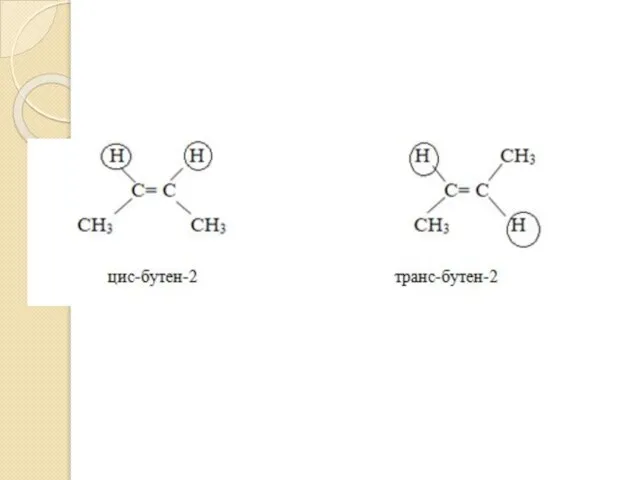
- 24. 3.Пространственные изомеры (цис- и транс- изомеры) Цис-изомер – 2 одинаковых заместителя находятся по одну сторону от
- 26. 4. Межклассовые изомеры (алкены изомерны циклоалканам)
- 27. Задание Напишите 6 изомеров, относящихся к разным видам изомерии для С5Н10 и назовите их.
- 28. Изомерия алкинов Изомерия строения углеродной цепи. Положения тройной связи. Межклассовая изомерия
- 29. 1. Изомерия углеродного скелета Разберем на примере С5Н8 (соответствует формуле СnH2n-2 – это алкин) Пишем цепочку
- 30. 2. Положения тройной связи
- 31. 3. Межклассовая изомерия алкины изомерны циклоалкенам и алкадиенам (2 двойные связи)
- 32. Задание Напишите 5 изомеров для С6Н10 и назовите их.
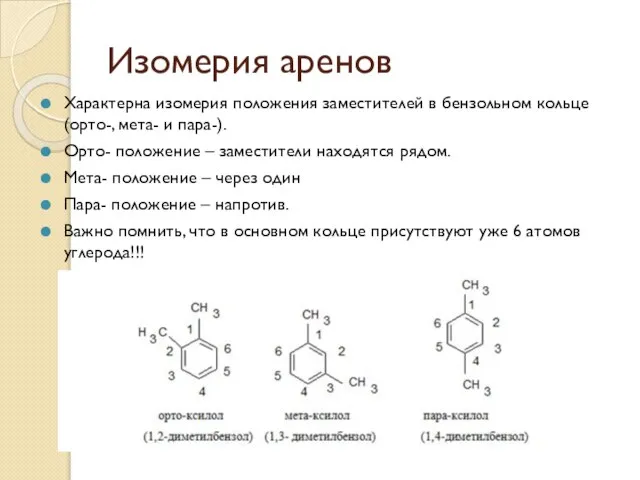
- 33. Изомерия аренов Характерна изомерия положения заместителей в бензольном кольце (орто-, мета- и пара-). Орто- положение –
- 34. Задание Напишите изомеры аренов для С9Н12 и назовите их. Подсказка: С9-С6(в основном кольце), получается, что в
- 35. Химические свойства углеводородов
- 36. Алканы Алканы имеют старинное название парафины, что означает, что они малоинертны. Дело в том, что атомы
- 37. Реакции замещения Более подробно разберем реакции замещения, хотя характерны и реакции горения, пиролиза, изомеризации, отщепления. Предельные
- 38. Правило Реакции замещения протекают по радикальному механизму в соответствии с нижеизложенным правилом. Замещение атомов водорода на
- 39. Реакция нитрования (Коновалова)
- 40. Реакция хлорирования
- 41. Химические свойства алкенов Двойная связь представляет собой сочетание σ- (прочной сигма) и π-(непрочной пи) связей. Поэтому
- 42. Реакции присоединения Присоединение водорода (гидрирования) или галогенов (галогенирования) всегда идёт по месту разрыва двойной связи. Аналогичным
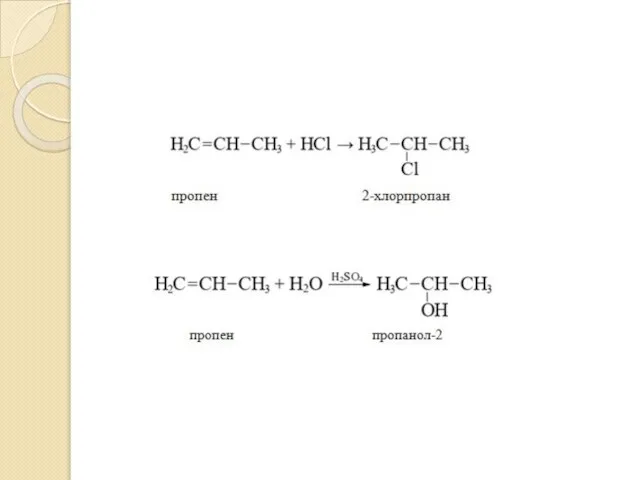
- 43. Реакция гидрогалогенирования и гидратации Несимметричные алкены присоединяют галогеноводороды (НBr,HCl) –гидрогалогенирование или воду (HOH) -гидратация) по правилу
- 45. Реакции полимеризации Под действием температуры, давления и в присутствии катализатора происходит разрыв π-связи и образование длинных
- 46. Реакции окисления Протекают в зависимости от условий. При мягком окислении водным раствором перманганата калия образуется двухатомный
- 47. Реакция окисления При горении (полном окислении) образуются углекислый газ, вода и тепло.
- 48. Химические свойства алкинов Тройная связь между атомами углерода включает одну σ-связь и две π-связи. Наличие π-связи
- 49. Реакции гидрогалогенирования и гидратации Данные реакции идут как с алкенами по правилу Марковникова
- 50. Особенность реакции гидратации Гидратация ацетиленовых углеводородов приводит к образованию карбонильных соединений. Гидратация ацетилена приводит к образованию
- 52. Реакция замещения!!!! (отличает алкены от алкинов) Соединённый с атомом углерода атом водорода может замещаться на металл,
- 53. Реакции окисления
- 54. Химические свойства аренов Арены имеют особый вид связи – ароматическую П-связь, состоящую из 6-Пи-электронов, она равномерно
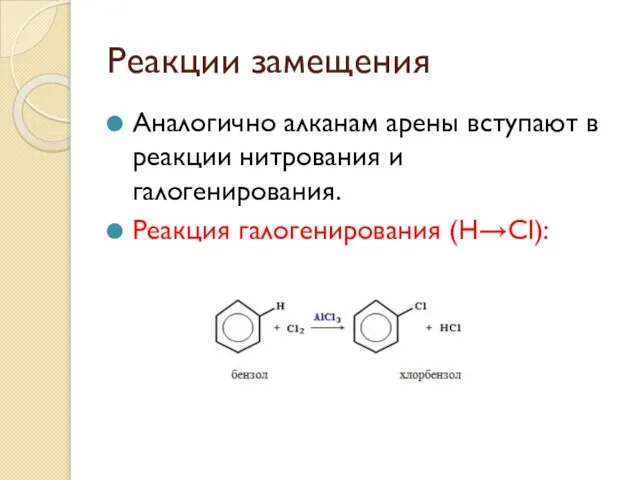
- 55. Реакции замещения Аналогично алканам арены вступают в реакции нитрования и галогенирования. Реакция галогенирования (Н→Сl):
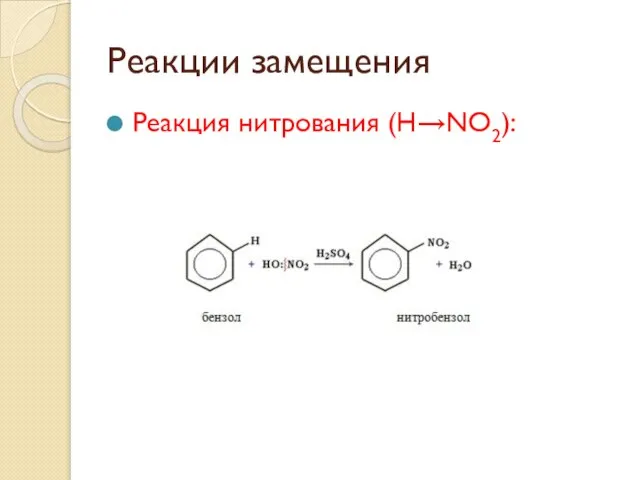
- 56. Реакции замещения Реакция нитрования (H→NO2):
- 57. Реакции замещения Реакции замещения у гомологов и изомеров аренов проходят согласно правилам ориентации в бензольном ядре.
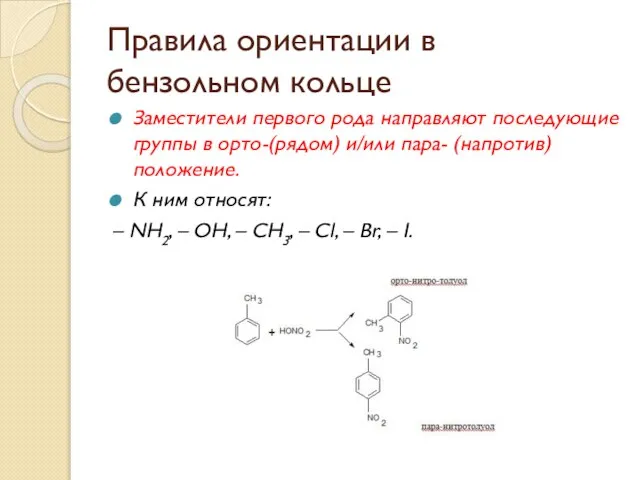
- 58. Правила ориентации в бензольном кольце Заместители первого рода направляют последующие группы в орто-(рядом) и/или пара- (напротив)
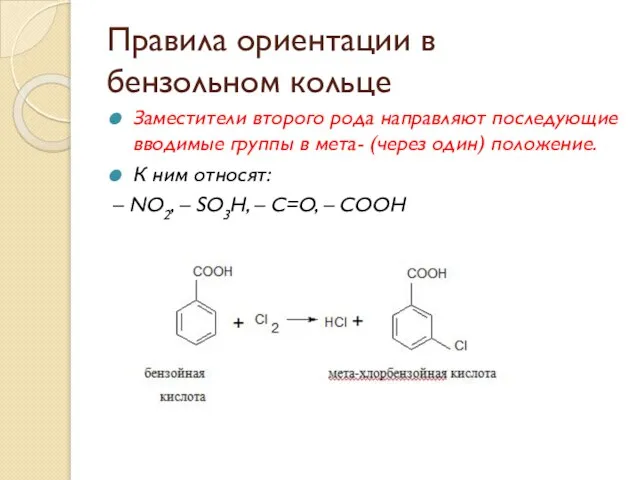
- 59. Правила ориентации в бензольном кольце Заместители второго рода направляют последующие вводимые группы в мета- (через один)
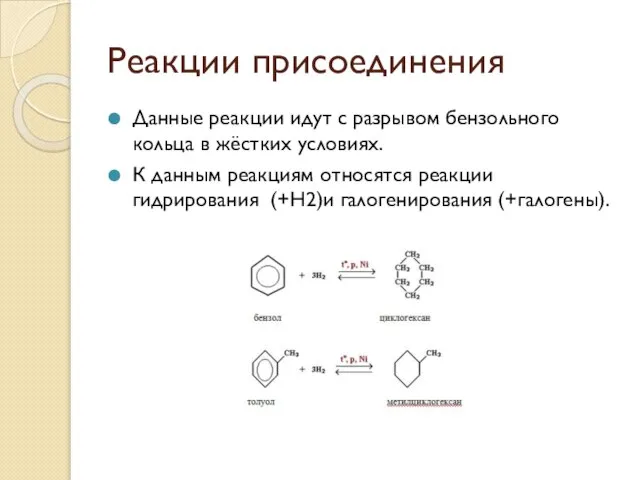
- 60. Реакции присоединения Данные реакции идут с разрывом бензольного кольца в жёстких условиях. К данным реакциям относятся
- 61. Реакции окисления Бензол окисляется с трудом, только под действием сильных окислителей. Гомологи бензолов окисляются легко до
- 63. Скачать презентацию
















































 Электролитическая диссоциация. Электролиты и неэлектролиты
Электролитическая диссоциация. Электролиты и неэлектролиты Характеристика галогенов
Характеристика галогенов Презентация на тему Роль химии в жизни человека
Презентация на тему Роль химии в жизни человека  Азот
Азот Воздействие нейропептидов семакс и PGP на содержание транскриптов гена в головном мозге крыс в условиях экспериментальной ишемии
Воздействие нейропептидов семакс и PGP на содержание транскриптов гена в головном мозге крыс в условиях экспериментальной ишемии Металлы
Металлы Возможности модернизации совместного производства фенола и ацетона кумольным способом
Возможности модернизации совместного производства фенола и ацетона кумольным способом Агрегатное состояние вещества
Агрегатное состояние вещества Ароматические углеводороды. Бензол
Ароматические углеводороды. Бензол аналит хим
аналит хим Дизельное топливо
Дизельное топливо Амины. 10 класс
Амины. 10 класс Растительные источники жиров и жирных масел
Растительные источники жиров и жирных масел Природные источники углеводородов. Нефть и природный газ, их применение. Полимеры
Природные источники углеводородов. Нефть и природный газ, их применение. Полимеры Электролиз
Электролиз Соли. Формула соли
Соли. Формула соли Космохимия или химическая космология
Космохимия или химическая космология Удивительные свойства латекса и его применение
Удивительные свойства латекса и его применение Общие физические и химические свойства металлов. 9 класс
Общие физические и химические свойства металлов. 9 класс Земная спираль Шанкуртуа
Земная спираль Шанкуртуа Алканы в торфянисто-подзолисто-глееватых почвах Габов Д.Н., Безносиков В.А., Кондратенок Б.М., Груздев И.В.
Алканы в торфянисто-подзолисто-глееватых почвах Габов Д.Н., Безносиков В.А., Кондратенок Б.М., Груздев И.В. Интеллектуальная игра по теме: «Периодический закон и система химических элементов Д.И. Менделеева». «Химический дом и его обитат
Интеллектуальная игра по теме: «Периодический закон и система химических элементов Д.И. Менделеева». «Химический дом и его обитат Фторопласты и их использование
Фторопласты и их использование Электрическая диссоциация
Электрическая диссоциация Щелочноземельные металлы
Щелочноземельные металлы Алюминий
Алюминий Презентация тема 7.5. 7.6
Презентация тема 7.5. 7.6 Основания
Основания