Характеристика химического элемента-неметалла на основании его положения в ПСХЭ Д.И.Менделеева. 9 класс
Содержание
- 2. Цели урока Дать план общей характеристики хим. элемента по его положению в ПСХЭ Повторить строение атома,
- 3. План характеристики ХЭ по его положению в ПСХЭ Адрес ХЭ Строение атома, проявляемые свойства, сравнение с
- 4. Дадим характеристику элемента ФОСФОРА Порядковый номер 15, 3 период (малый), 5 группа, главная подгруппа (VA) +15
- 5. Сравним свойства атома фосфора с соседними ХЭ по группе и периоду В группе : Азот -
- 6. Фосфор – простое вещество Неметалл, имеет разные аллотропные модификации (красный, белый – яд, смерть – 50
- 7. Оксиды фосфора – Р2O3, Р2О5 Солеобразующие, кислотные Ковалентная полярная связь (записать схему образования связи) Белый цвет
- 8. Фосфорная кислота- H3РО4 Н+ - РО43- ковалентная полярная связь Н+ - простой ион, РО43- - сложный
- 9. Водородное соединение – РH3 фосфид водорода (фосфин) Ядовитый, химически активный, бесцветный газ со слабым чесночным запахом,
- 10. Открытие фосфора – «светящийся» открыт гамбургским алхимиком Хеннигом Брандом в 1669 году из человеческой мочи (phosphorus
- 11. Получение фосфора из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре 1600
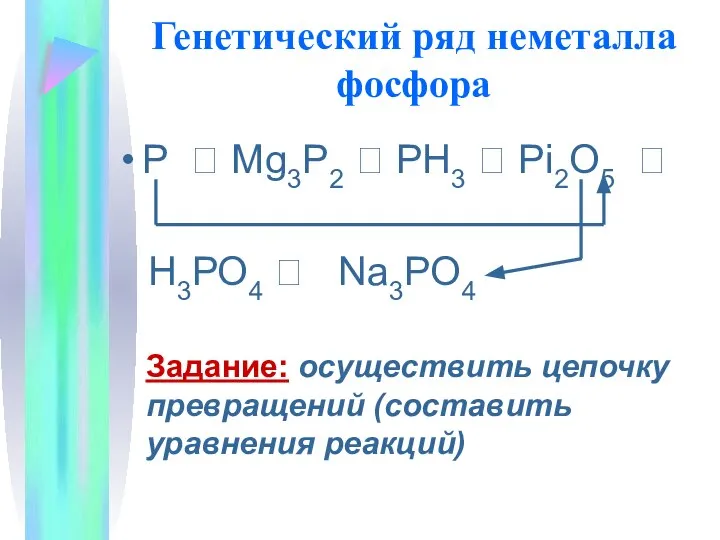
- 12. Генетический ряд неметалла Вспомните признаки генетического ряда: Один и тот же химический элемент-неметалл Разные формы существования
- 13. Генетический ряд неметалла фосфора Р ? Mg3P2 ? PH3 ? Рi2O5 ? H3РО4 ? Na3PO4 Задание:
- 14. Задачи на выход продукта реакции Вычислить выход нитрата аммония (NH4NO3) в % от теоретически возможного, если
- 15. Вспомним формулы! η – выход продукта m пр. V пр. η = ----- = ------- m
- 16. РЕШИТЕ ЗАДАЧИ При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5,5
- 17. №1. При взаимодействии натрия количеством вещества 0,5 моль с водой получили водород объёмом 4,2 л (н.
- 19. Скачать презентацию















 Презентация на тему Хлор
Презентация на тему Хлор  Презентация Microsoft PowerPoint
Презентация Microsoft PowerPoint Химико-технологические процессы современных производств
Химико-технологические процессы современных производств Амины. Аминокислоты
Амины. Аминокислоты Химические реакции в органической химии
Химические реакции в органической химии Катаболизм пуриновых нуклеотидов
Катаболизм пуриновых нуклеотидов Металлы. Группы металлов
Металлы. Группы металлов Биопластик на основе лигнина
Биопластик на основе лигнина Турнир знатоков. Интеллектуальная игра
Турнир знатоков. Интеллектуальная игра Учебная мотивация как показатель качества образования (на уроках химии)
Учебная мотивация как показатель качества образования (на уроках химии) Кислоты. Начальные сведения
Кислоты. Начальные сведения Щелочноземельные металлы
Щелочноземельные металлы Первоначальные химические понятия
Первоначальные химические понятия 60d677dc87dcd9320c87dd4e7b80d6ac
60d677dc87dcd9320c87dd4e7b80d6ac Контрольна робота, хімія
Контрольна робота, хімія Соли. Химические свойства
Соли. Химические свойства Презентация на тему Руды металлов
Презентация на тему Руды металлов  Наша стирка по-байкальски. Синтетические моющие средства (СМС¸ детергенты)
Наша стирка по-байкальски. Синтетические моющие средства (СМС¸ детергенты) Сложные эфиры. Организация внеаудиторной творческой работы учащихся
Сложные эфиры. Организация внеаудиторной творческой работы учащихся VII Межрегиональная метапредметная конференции Удивительный мир научных книг. Ситуационные задания по химии
VII Межрегиональная метапредметная конференции Удивительный мир научных книг. Ситуационные задания по химии 11кл. 06.10 Презентация по теме _ ПСХЭ Д. И.Менделеева _11 класс
11кл. 06.10 Презентация по теме _ ПСХЭ Д. И.Менделеева _11 класс Химико-металлургические методы
Химико-металлургические методы Арены. Электронное строение молекулы бензола. Гомологический ряд аренов, номенклатура, изомерия
Арены. Электронное строение молекулы бензола. Гомологический ряд аренов, номенклатура, изомерия Жиры. Строение жиров
Жиры. Строение жиров Электролитическая диссоциация
Электролитическая диссоциация Углеводороды. Природный газ. Алканы
Углеводороды. Природный газ. Алканы Положение металлов в периодической системе химических элементов
Положение металлов в периодической системе химических элементов Классификация коррозионных процессов металлов
Классификация коррозионных процессов металлов