Содержание
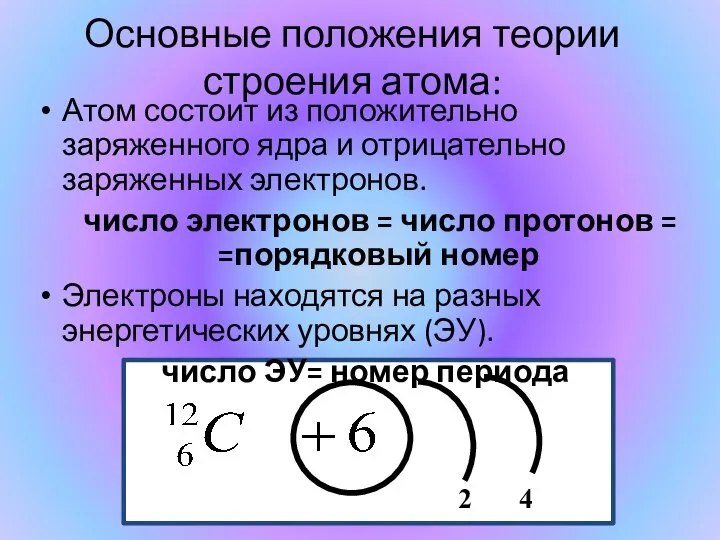
- 2. Основные положения теории строения атома: Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов. число
- 3. Нельзя проследить траекторию движения электрона. Область, в которой нахождение электрона наиболее вероятно, называют орбиталью. Орбитали различаются
- 4. Виды орбиталей (по форме): s-орбиталь р-орбиталь d-орбиталь f-орбиталь
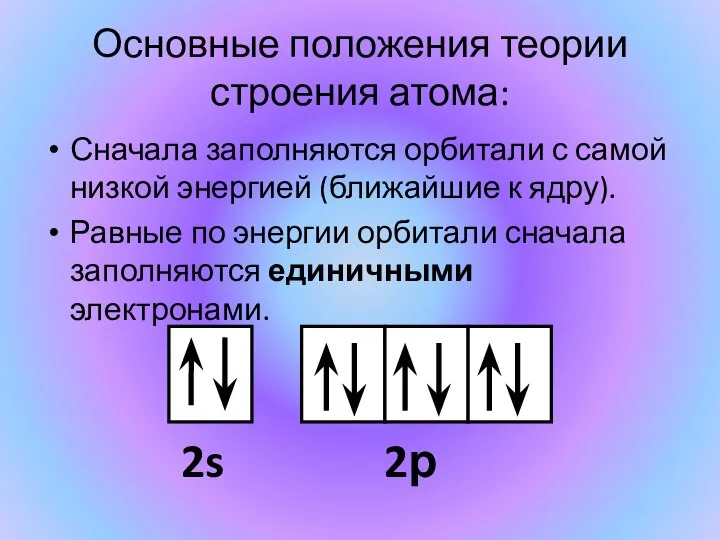
- 5. Сначала заполняются орбитали с самой низкой энергией (ближайшие к ядру). Равные по энергии орбитали сначала заполняются
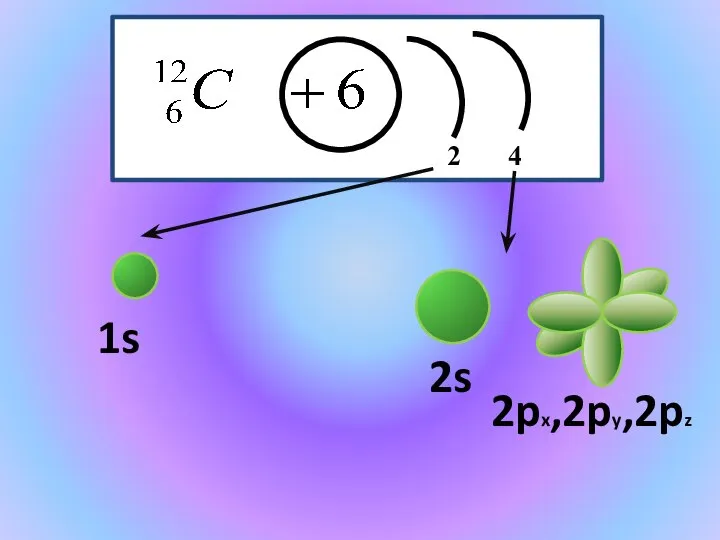
- 6. 1s 2px,2py,2pz 2s
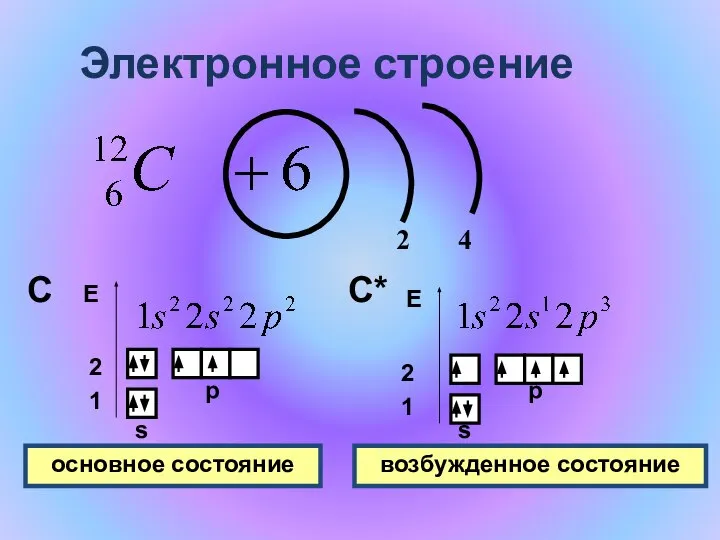
- 7. Электронное строение 2 4 1 2 s p С Е s p С* основное состояние возбужденное
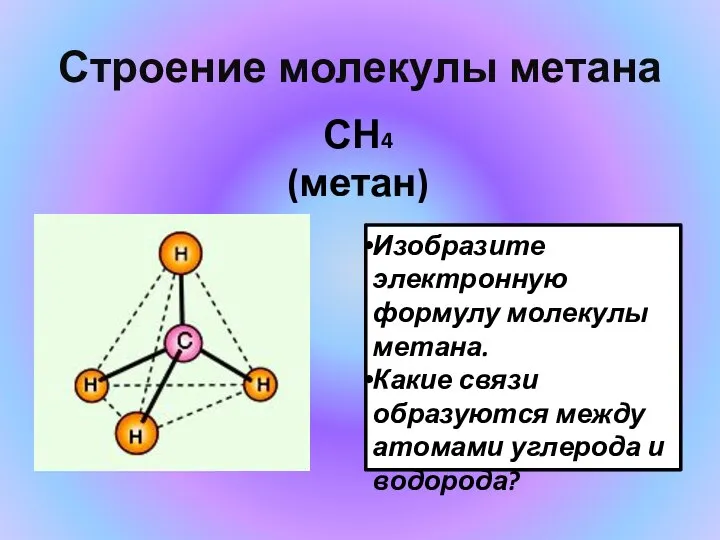
- 8. Строение молекулы метана СН4 (метан) Изобразите электронную формулу молекулы метана. Какие связи образуются между атомами углерода
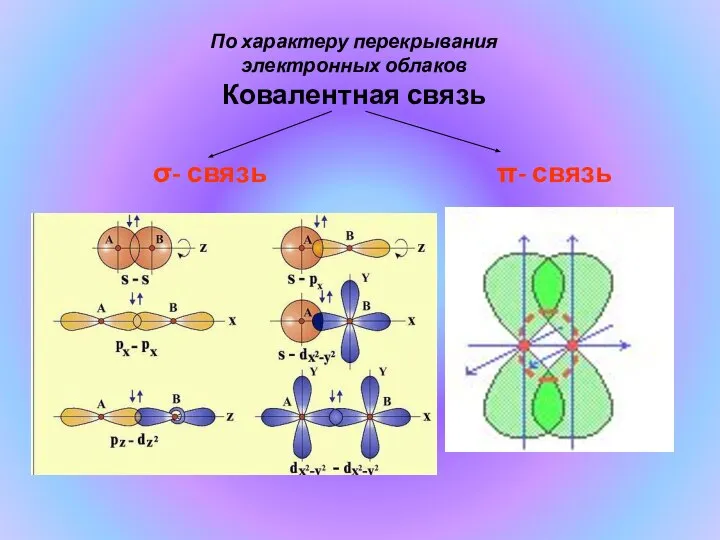
- 9. По характеру перекрывания электронных облаков Ковалентная связь σ- связь π- связь
- 10. Химические связи, образующиеся в результате перекрывания орбиталей вдоль линии, соединяющей центры ядер двух атомов, называют σ-связями.
- 12. Скачать презентацию



 Урок №10 12 класс
Урок №10 12 класс Характеристика элемента по Периодической системе Д.И. Менделеева
Характеристика элемента по Периодической системе Д.И. Менделеева Непредельные углеводороды
Непредельные углеводороды Молибден. Получение молибдена
Молибден. Получение молибдена Алюминий. 9 класс
Алюминий. 9 класс Сульфиды
Сульфиды Презентация на тему Электронное и пространственное строение молекулы метана
Презентация на тему Электронное и пространственное строение молекулы метана 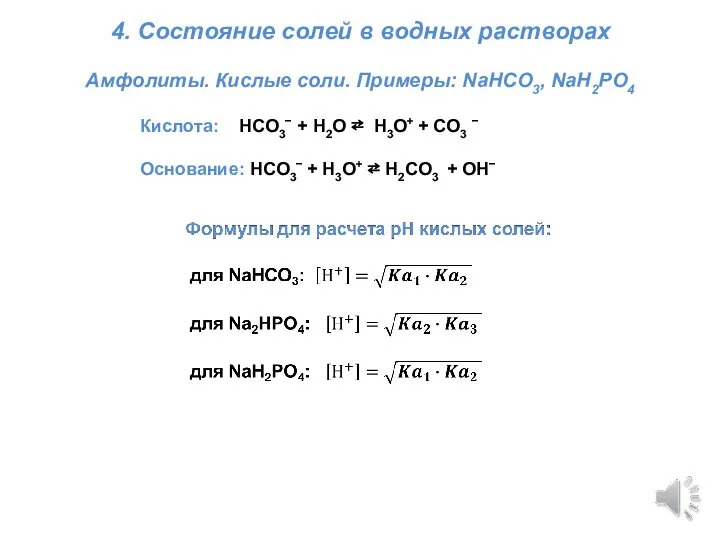 Титриметрия. Состояние солей в водных растворах
Титриметрия. Состояние солей в водных растворах Карбонильные производные (кислоты, альдегиды, кетоны, сложные эфиры)
Карбонильные производные (кислоты, альдегиды, кетоны, сложные эфиры) Техника безопасности при работе в химическом кабинете
Техника безопасности при работе в химическом кабинете Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома
Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома Введение в практическую деятельность
Введение в практическую деятельность Диаграмма состояния BaO-Al2O3-SiO2
Диаграмма состояния BaO-Al2O3-SiO2 Ferrum железо
Ferrum железо Обобщение металлов
Обобщение металлов Презентация на тему В мире индикаторов - исследовательская работа
Презентация на тему В мире индикаторов - исследовательская работа  Основные полимеры, используемые для производства электроизоляционных материалов и пропиточных составов
Основные полимеры, используемые для производства электроизоляционных материалов и пропиточных составов Металлическая химическая связь
Металлическая химическая связь Сложные эфиры. Жиры
Сложные эфиры. Жиры Реакции поликонденсации
Реакции поликонденсации Алкены
Алкены Коррозия металлов и сплавов
Коррозия металлов и сплавов Toshkent davlat texnika instituti
Toshkent davlat texnika instituti Кислотность почв с.Берёзовка МОУ «СОШ с.Берёзовка» Колесников Иван, 9 класс Пряхина Виктория, 8 класс
Кислотность почв с.Берёзовка МОУ «СОШ с.Берёзовка» Колесников Иван, 9 класс Пряхина Виктория, 8 класс Синтетические моющие средства
Синтетические моющие средства Инновационное производство синтетических мелкокодисперсных оксидов и оборудования для их изготовления
Инновационное производство синтетических мелкокодисперсных оксидов и оборудования для их изготовления Теория электролитической диссоциации. Контрольный тест
Теория электролитической диссоциации. Контрольный тест Електролітична дисоціація
Електролітична дисоціація