Содержание
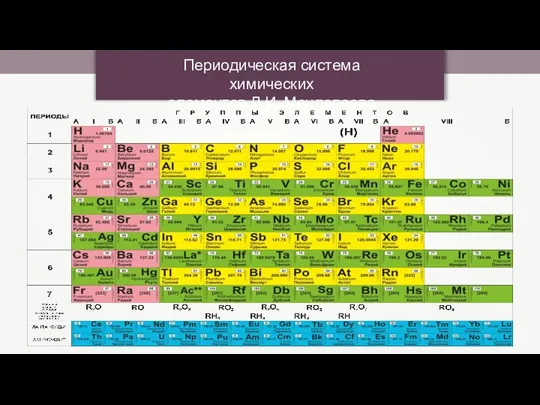
- 2. Периодическая система химических элементов Д.И. Менделеева
- 3. МЕТАЛЛЫ И НЕМЕТАЛЛЫ
- 4. Если от элемента бора (В) провести условную линию к элементу астату (At), то в главных подгруппах
- 5. СТРОЕНИЕ АТОМА Атомы имеют сложное строение: вокруг положительно заряженного массивного ядра движутся по определённым орбитам с
- 6. ФОРМУЛЫ АТОМОВ В современной химии строение атомов принято изображать при помощи электронно-графических формул. На этой схеме
- 7. ФОРМУЛЫ АТОМОВ На таких формулах квадратом обозначается электронная орбиталь, стрелки внутри квадрата символизируют электроны, этажное расположение
- 8. ПОЛОЖЕНИЕ В СИСТЕМЕ По положению в Системе можно определить: Заряд ядра, число протонов в ядре и
- 9. ХАРАКТЕРИСТИКИ ЭЛЕМЕНТА Химический элемент можно характеризовать по следующим пунктам: Положение в Периодической системе; Металл или неметалл;
- 10. ВЗАИМОДЕЙСТВИЯ АТОМОВ Для атомов присуще стремление приобрести более устойчивую и энергетически выгодную электронную конфигурацию, характерную для
- 11. Каждый элемент занимает строго отведенную ему ячейку, которая расположена в определенном периоде и определенной группе. В
- 12. План – алгоритм характеристики элемента по его положению в ПСХЭ Д. И. Менделеева 1. Название 2.
- 13. Подсказка! Число электронов = числу протонов = порядковому номеру; Число нейтронов = атомная масса (Ar из
- 14. 7. Вид элемента (s, p, d, f) Подсказка! s-элементы: это первые два элемента в 1-7 периодах;
- 15. 8. Схема строения атома (распределение электронов по энергоуровням), завершённость внешнего уровня. Подсказка! Внешний уровень завершён у
- 16. Подсказка! Для написания схемы нужно знать следующее: Заряд ядра атома = порядковому номеру атома; Число энергетических
- 17. 4. У d - элементов на последнем уровне число электронов всегда равно 2 (исключения – хром,
- 18. Максимальное возможное число электронов на уровнях определяют по формуле: Nэлектронов = 2n2, где n – номер
- 19. 9. Электронная и электронно-графическая формулы строения атома Подсказка! Для написания электронной формулы используйте шкалу энергий: s
- 20. 10. Металл или неметалл Подсказка! К неметаллам относятся: 2 s-элемента - водород и гелий и 20
- 21. 11. Высший оксид (только для s, p) Подсказка! Общая формула высшего оксида дана под группой химических
- 22. 12. Летучее водородное соединение (только для s, p) Подсказка! Общая формула летучего водородного соединения дана под
- 24. Скачать презентацию




















 ЭТА УВЛЕКАТЕЛЬНАЯ ХИМИЯ… Первый урок химии в 8 классе Абрамова С.И., учитель химии МОУ «Лихославльская СОШ №2» Тверской области
ЭТА УВЛЕКАТЕЛЬНАЯ ХИМИЯ… Первый урок химии в 8 классе Абрамова С.И., учитель химии МОУ «Лихославльская СОШ №2» Тверской области Производство органических препаратов ароматического ряда
Производство органических препаратов ароматического ряда Удивительные кристаллы Выполнена учеником 8 а класса Савиным Анатолием Учитель: Звёздочкина С.А.
Удивительные кристаллы Выполнена учеником 8 а класса Савиным Анатолием Учитель: Звёздочкина С.А. Лиофильные и лиофобные дисперсные системы. Свойства лиофильных систем. Лекция 12
Лиофильные и лиофобные дисперсные системы. Свойства лиофильных систем. Лекция 12 Исследовательская работа на тему: «Выращивание кристалла в домашних условиях» Работу выполнила ученица 10-а класса Алексеева О
Исследовательская работа на тему: «Выращивание кристалла в домашних условиях» Работу выполнила ученица 10-а класса Алексеева О Вторичная переработка нефти. Крекинг
Вторичная переработка нефти. Крекинг Щелочноземельные металлы
Щелочноземельные металлы Ароматические и гетероциклические соединения. Электронная спектроскопия
Ароматические и гетероциклические соединения. Электронная спектроскопия Агрегатные состояния вещества
Агрегатные состояния вещества Диффузия и осмос
Диффузия и осмос Незаменимая уксусная кислота
Незаменимая уксусная кислота Положение металлов в периодической системе химических элементов
Положение металлов в периодической системе химических элементов Соли. 8 класс
Соли. 8 класс Математика в химии
Математика в химии Мутагены окружающей среды
Мутагены окружающей среды Общие способы получения металлов
Общие способы получения металлов Турнир Знатоков Химии
Турнир Знатоков Химии Общая характеристика неметаллов
Общая характеристика неметаллов Spectroscopy. U.V. Lect.2
Spectroscopy. U.V. Lect.2 Презентация на тему Коррозия металлов (11 класс)
Презентация на тему Коррозия металлов (11 класс)  Электронная структура атомов
Электронная структура атомов ізомери
ізомери Аэрозоли и аэродисперсии
Аэрозоли и аэродисперсии Химия. Контроль знаний
Химия. Контроль знаний Наблюдения в сходящемся свете. Коноскопия
Наблюдения в сходящемся свете. Коноскопия Методика измерений массовой концентрации ионов аммония в природных и сточных водах фотометрическим методом с реактивом Несслера
Методика измерений массовой концентрации ионов аммония в природных и сточных водах фотометрическим методом с реактивом Несслера Метаболизм липидов
Метаболизм липидов Презентация на тему Роль химии в жизни человека
Презентация на тему Роль химии в жизни человека