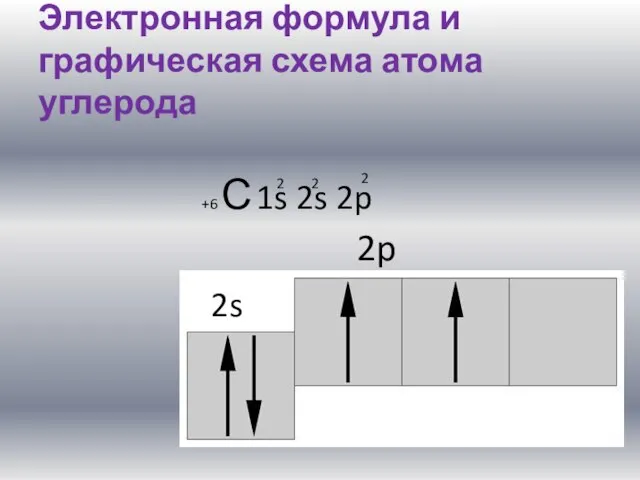
Слайд 2Электронная формула и графическая схема атома углерода
+6 С 1s 2s 2p
2
2
2
2s
2p
Слайд 3
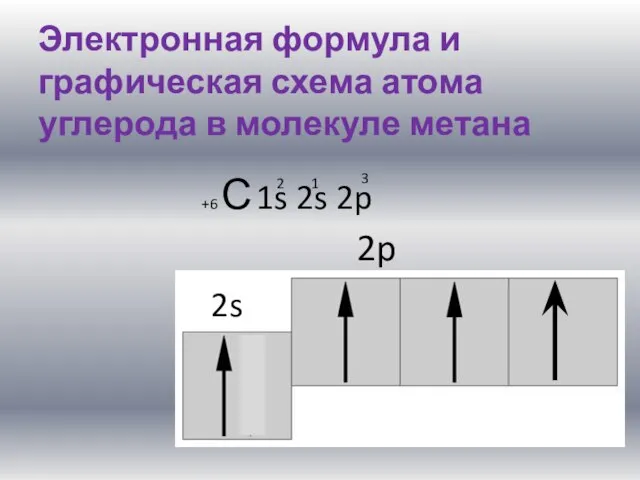
Электронная формула и графическая схема атома углерода в молекуле метана
+6 С
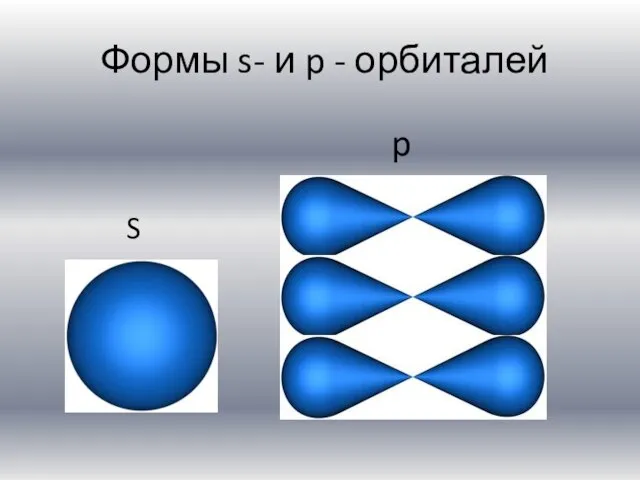
Слайд 4 Формы s- и p - орбиталей
S
p
Слайд 5Гибридизация
Гибридизация – выравнивание электронных орбиталей по форме и энергии

Слайд 6Образование четырех гибридных орбиталей. Гибридизация - Sp3
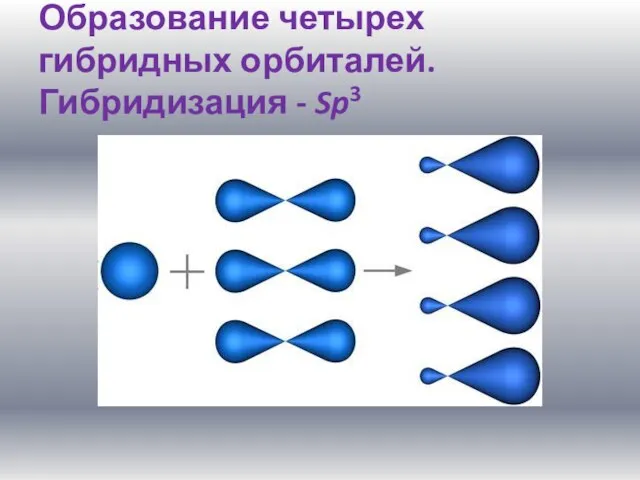
Слайд 7Четыре sp3-гибридные орбитали симметрично ориентированны в пространстве под углом 109°28'

Слайд 9В пространстве молекула метана напоминает тетраэдр
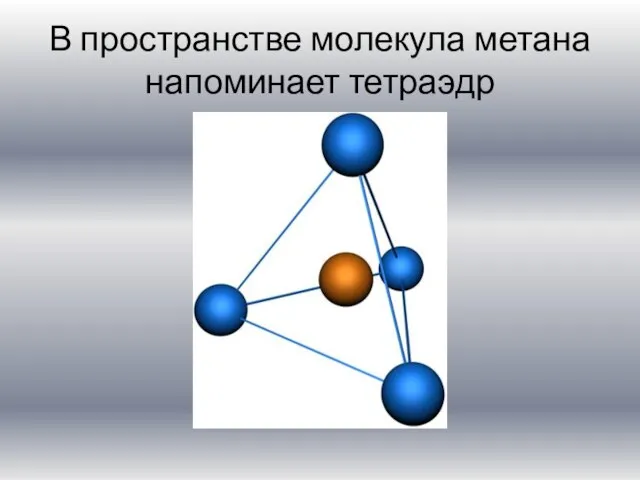
Слайд 10Алканы
Алканы- это углеводороды, имеющие общую формулу CnH2n+2, в молекулах которых все

атомы углерода находятся в состоянии sp3 гибридизации и соединены между собой только σсвязями.
Слайд 11Характеристика молекулы метана
Гибридизация
Угол связи
Форма молекулы в пространстве
Длина связи
Все атомы соединены
Sp3
109°28‘
Тетраэдрическая
0, 154

нм
σ (сигма) связью
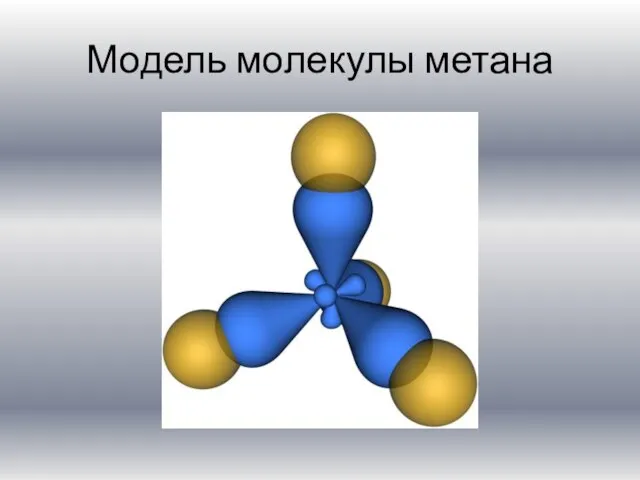
Слайд 12Составим самостоятельно
модель молекулы метана
Домашнее задание
Лабораторный опыт № 1 стр. 28

учебник
Выполнить дома
Выучить § 5 упр. 3, 4 в тетрадях письменно










 Процессы в растворах: электролитическая диссоциация (ЭД)
Процессы в растворах: электролитическая диссоциация (ЭД) Кислоты. Презентация к уроку химии в 8 классе
Кислоты. Презентация к уроку химии в 8 классе Алкины
Алкины Витамины. Классификация витаминов
Витамины. Классификация витаминов Галогены
Галогены Закономерности изменения свойств элементов и их соединений по периодам и группам
Закономерности изменения свойств элементов и их соединений по периодам и группам Названия комплексов с мостиковыми лигандами
Названия комплексов с мостиковыми лигандами Молярный объем газов. Закон Авогадро
Молярный объем газов. Закон Авогадро Химическая география чудес
Химическая география чудес Электрические явления на поверхности раздела фаз. Лекция 8
Электрические явления на поверхности раздела фаз. Лекция 8 Синтетические моющие средства
Синтетические моющие средства АТФ - аденозинтрифосфорная кислота
АТФ - аденозинтрифосфорная кислота Степень окисления. Электроотрицательность. Формулы бинарных соединений
Степень окисления. Электроотрицательность. Формулы бинарных соединений Систематизация знаний по периодической системе химических элементов
Систематизация знаний по периодической системе химических элементов Изомерия. Виды изомерии
Изомерия. Виды изомерии Специальные виды перегонки
Специальные виды перегонки Введение в метаболизм
Введение в метаболизм Подготовка к олимпиаде по химии. Некоторые идеи составления и решения нестандартны задач
Подготовка к олимпиаде по химии. Некоторые идеи составления и решения нестандартны задач Основания. Схема образования гидроксида натрия
Основания. Схема образования гидроксида натрия Строение воды
Строение воды Минералы
Минералы Основания. 8 класс
Основания. 8 класс Путешествие по городу химиков
Путешествие по городу химиков Движение молекул
Движение молекул Химические элементы. Викторина
Химические элементы. Викторина Металлом называется светлое тело, которое ковать можно
Металлом называется светлое тело, которое ковать можно Количество вещества
Количество вещества Очистка различных поверхностей от нефтяных загрязнений
Очистка различных поверхностей от нефтяных загрязнений