Содержание
- 2. Гидролизующиеся соли ГИДРОЛИЗ – реакция взаимодействия солей с водой
- 3. Соль, которая подвергается гидролизу и по аниону и по катиону: (CH3COO) NH4 Соль, образованная слабой кислотой
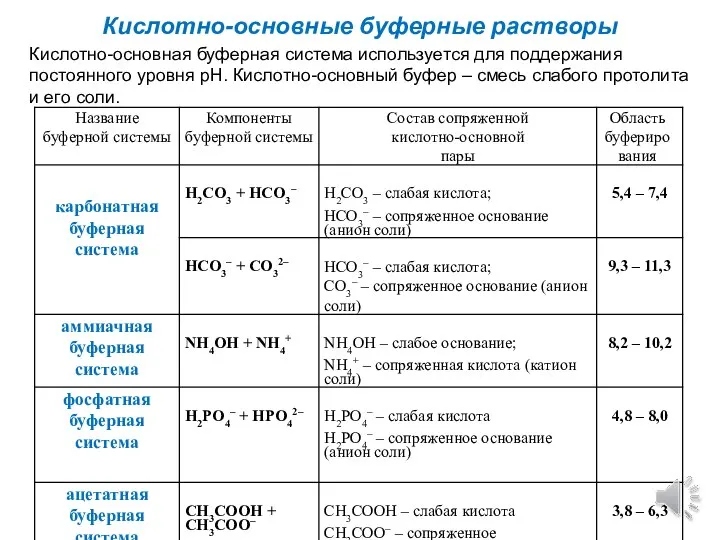
- 4. Кислотно-основные буферные растворы Кислотно-основная буферная система используется для поддержания постоянного уровня рН. Кислотно-основный буфер – смесь
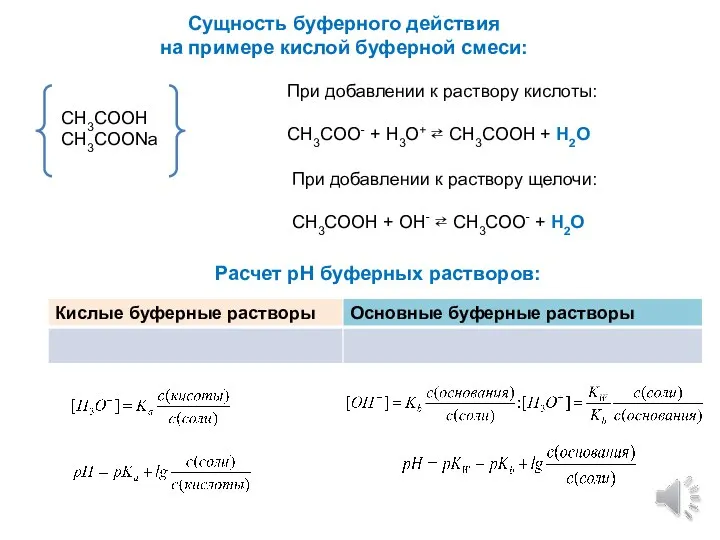
- 5. Сущность буферного действия на примере кислой буферной смеси: CH3COOH CH3COONa При добавлении к раствору кислоты: CH3COO-
- 6. Вычислить рН раствора, полученного сливанием 20 мл 0,015 М раствора нитрита натрия и 15 мл раствора
- 7. Свойства буферных растворов Значение рН буферного раствора остается неизменным при разбавлении; При добавлении кислот или щелочей
- 8. Формулы для расчета концентрации ионов H+ в растворах протолитов
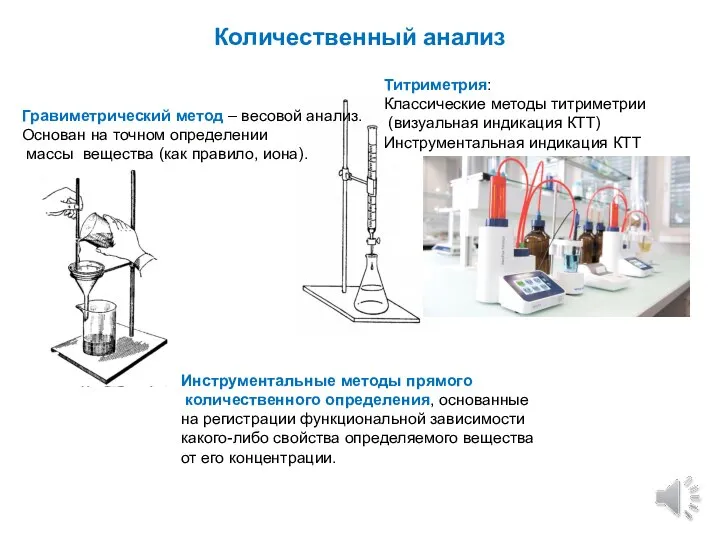
- 9. Количественный анализ Гравиметрический метод – весовой анализ. Основан на точном определении массы вещества (как правило, иона).
- 11. Скачать презентацию





 Соли Na2SO4
Соли Na2SO4 Конструкционные и функциональные материалы: конструкционные материалы. Введение
Конструкционные и функциональные материалы: конструкционные материалы. Введение Механизмы и методы формирования кристаллов
Механизмы и методы формирования кристаллов Окисно-відновні реакції. Процеси окиснення та відновлення, окисники та відновники. 9 клас
Окисно-відновні реакції. Процеси окиснення та відновлення, окисники та відновники. 9 клас Сравнительный анализ питьевой бутилированной воды
Сравнительный анализ питьевой бутилированной воды Физические и химические явления 8 класс Учитель химии Кузнецова А.Н.
Физические и химические явления 8 класс Учитель химии Кузнецова А.Н. ДИЕНОВЫЕ УГЛЕВОДОРОДЫ. КАУЧУКИ.
ДИЕНОВЫЕ УГЛЕВОДОРОДЫ. КАУЧУКИ. Презентация на тему Общая характеристика металлов главных подгрупп I-III
Презентация на тему Общая характеристика металлов главных подгрупп I-III 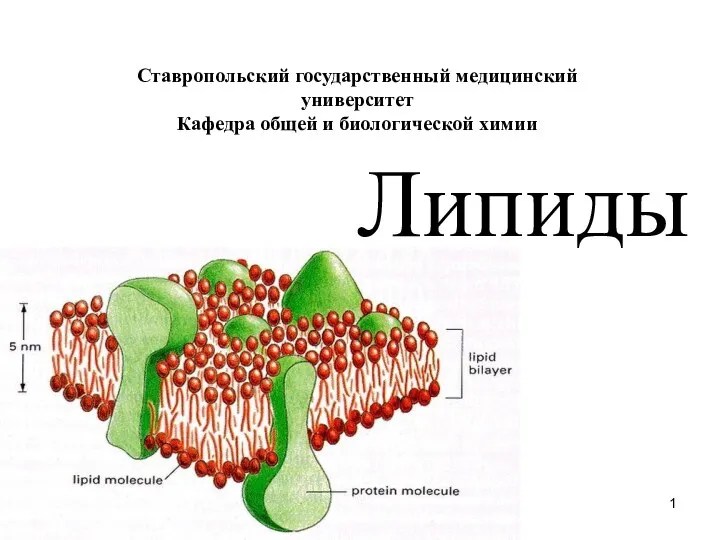 Липиды
Липиды Презентация на тему Производство чугуна и стали
Презентация на тему Производство чугуна и стали  Термопласты: основные представители, сравнение свойств и область их применения
Термопласты: основные представители, сравнение свойств и область их применения Методы разделения катализаторов и продуктов, используемые для гомогенно-каталитических реакционных систем
Методы разделения катализаторов и продуктов, используемые для гомогенно-каталитических реакционных систем Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Основные классы неорганических соединений
Основные классы неорганических соединений Три агрегатных состояния веществ
Три агрегатных состояния веществ Gelation in aqueous solution of L-cysteine and silver nitrate
Gelation in aqueous solution of L-cysteine and silver nitrate metally_mikhaylets
metally_mikhaylets Презентация по Химии "Классификация реакций в неорганической химии"
Презентация по Химии "Классификация реакций в неорганической химии"  Презентация на тему Химия и пища
Презентация на тему Химия и пища  Соли
Соли Все свойства минералов
Все свойства минералов Группа веществ, требующих особых методов изолирования. Характеристика соединений. Токсикологическое значение
Группа веществ, требующих особых методов изолирования. Характеристика соединений. Токсикологическое значение Структура периодической таблицы элементов
Структура периодической таблицы элементов Что такое эксперимент?
Что такое эксперимент? лекция 1-к.н.с.-ИАИТ-2022
лекция 1-к.н.с.-ИАИТ-2022 alkany_stroenie_nomenklatura_izomeriya_10_klass (3)-1
alkany_stroenie_nomenklatura_izomeriya_10_klass (3)-1 Полисахариды. Крахмал и целлюлоза
Полисахариды. Крахмал и целлюлоза Удивительные кристаллы Выполнена учеником 8 а класса Савиным Анатолием Учитель: Звёздочкина С.А.
Удивительные кристаллы Выполнена учеником 8 а класса Савиным Анатолием Учитель: Звёздочкина С.А.