Содержание
- 2. Понятие об алкинах Алкины – непредельные углеводороды, содержащие в молекуле, помимо одинарных связей, одну тройную связь
- 3. Характеристика тройной связи Вид гибридизации – sp Валентный угол – 180 Длина связи − С ≡
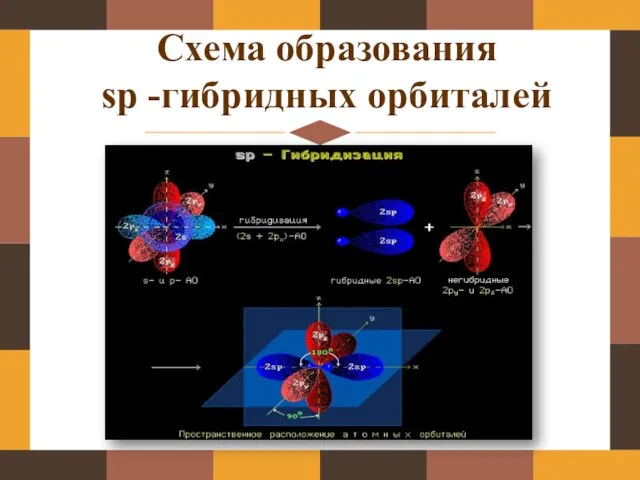
- 4. Схема образования sp -гибридных орбиталей
- 5. Схема образования sp -гибридных орбиталей
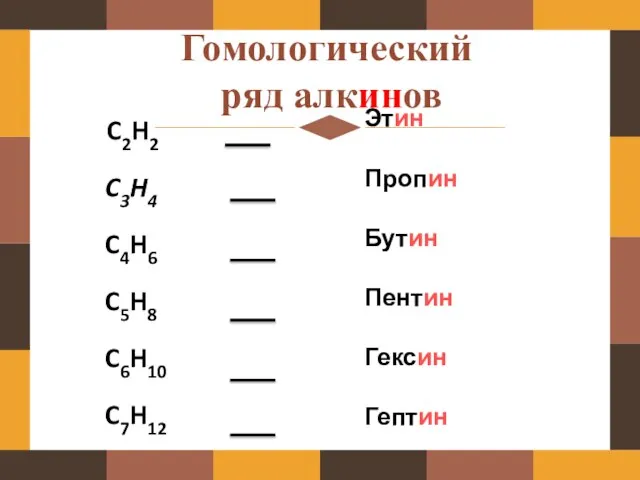
- 6. Гомологический ряд алкинов C2H2 C3H4 C4H6 C5H8 C6H10 C7H12 Этин Пропин Бутин Пентин Гексин Гептин
- 7. Изомерия алкинов Структурная изомерия 1. Изомерия положения тройной связи (начиная с С4Н6): СН ≡С−СН2−СН3 СН3−С≡С−СН3 бутин-1
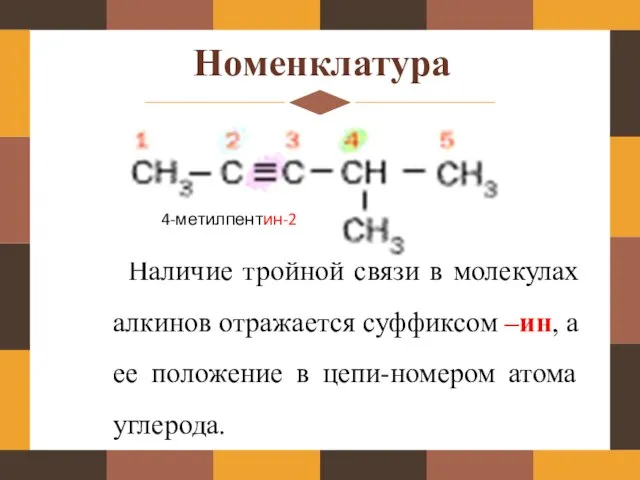
- 8. Номенклатура Наличие тройной связи в молекулах алкинов отражается суффиксом –ин, а ее положение в цепи-номером атома
- 9. Физические свойства Температуры кипения и плавления алкинов, так же как и алкенов, закономерно повышаются при увеличении
- 10. Получение алкинов Ацетилен получают в промышленности двумя способами: 1. Метановый способ: 1500°С 2СН4 ⎯⎯→ С2Н2 ↑+
- 11. Химические свойства алкинов Химические свойства ацетилена и его гомологов в основном определяются наличием в их молекулах
- 12. Реакции присоединения 1. Галогенирование Обесцвечивание бромной воды является качественной реакцией на все непредельные углеводороды. CH≡CH+Br2→CHBr═CHBr 1,2-дибромэтен
- 13. 2. Гидрогалогенирование (по правилу Марковникова). СH3-C≡CH + HBr→CH3-CBr═CH2 2-бромпропен CH3-CBr═CH2 + HBr→CH3-CBr2-CH3 2,2 – дибромпропан 3.
- 14. Окисление Алкины обесцвечивают раствор KMnO4, что используется для их качественного определения. R−C≡C−R’ + [O] + H2O
- 15. Горение ацетилена Ацетилен горит коптящим пламенем с выделением большого количества теплоты 2HC≡CH + 5О2 ⎯→ 4СО2
- 16. Реакции замещения При взаимодействии ацетилена (или R−C≡C−H) с аммиачными растворами оксида серебра выпадают осадки нерастворимых ацетиленидов:
- 17. Реакции полимеризации 1. Димеризация под действием водного раствора CuCl и NH4Cl: НC≡CH + НC≡CH ⎯→ Н2C=CH−C≡CH
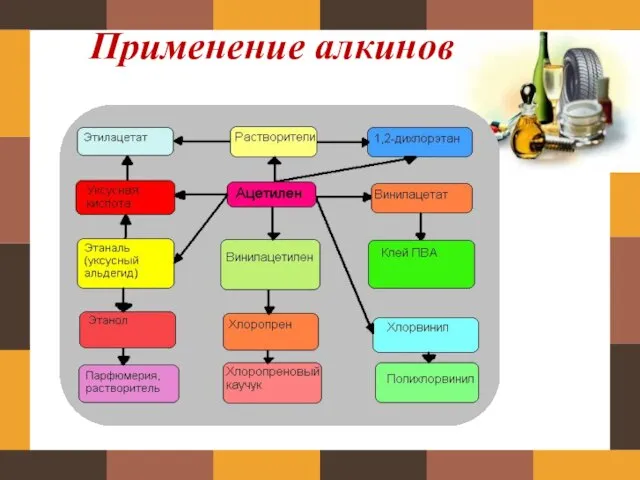
- 18. Применение алкинов
- 20. Скачать презентацию













 Валентность. Нахождение химической формулы вещества по валентности
Валентность. Нахождение химической формулы вещества по валентности Экспериментальное исследование кипения сверхтекучего гелия на цилиндрическом нагревателе внутри пористой оболочки
Экспериментальное исследование кипения сверхтекучего гелия на цилиндрическом нагревателе внутри пористой оболочки Алюминий и его свойства
Алюминий и его свойства Презентация на тему Из чего сделаны северные трубопроводы
Презентация на тему Из чего сделаны северные трубопроводы  Патриотическое воспитание школьников на уроках
Патриотическое воспитание школьников на уроках Презентация на тему Элементы главной подгруппы V группы
Презентация на тему Элементы главной подгруппы V группы  Смеси и взвеси веществ. Простейшие операции с веществом
Смеси и взвеси веществ. Простейшие операции с веществом Порядок констант ССВ JHH в бензоле. Задачи
Порядок констант ССВ JHH в бензоле. Задачи Методы анализа структуры белка
Методы анализа структуры белка Презентация на тему Экологические риски при добыче и переработке нефти
Презентация на тему Экологические риски при добыче и переработке нефти  Галогены
Галогены Аллотропия кислорода. Состав воздуха
Аллотропия кислорода. Состав воздуха Обобщение. Неметаллы
Обобщение. Неметаллы Свойства кальция и магния. Жёсткость воды. Лекция №7
Свойства кальция и магния. Жёсткость воды. Лекция №7 Презентация на тему Химия и проблемы экологии. Кислотные дожди
Презентация на тему Химия и проблемы экологии. Кислотные дожди  Степени окисления и формулы веществ
Степени окисления и формулы веществ Презентация на тему Алканы (10 класс)
Презентация на тему Алканы (10 класс)  Prezentatsia_lektsia_Reaktora_1_Klassifikatsia
Prezentatsia_lektsia_Reaktora_1_Klassifikatsia Презентация на тему День Земли, Воды и Чистого воздуха
Презентация на тему День Земли, Воды и Чистого воздуха  Взаимодействие цинка с разбавленной соляной кислотой. Лабораторный опыт. Шаблон
Взаимодействие цинка с разбавленной соляной кислотой. Лабораторный опыт. Шаблон Презентация на тему Способы получения металлов
Презентация на тему Способы получения металлов  Пространственное строение. Стереоизомерия. Структура и функции биолекул
Пространственное строение. Стереоизомерия. Структура и функции биолекул Презентация на тему Серная кислота (9 класс)
Презентация на тему Серная кислота (9 класс)  Решение задач ЕГЭ
Решение задач ЕГЭ Алкадиены. Физические свойства
Алкадиены. Физические свойства Предмет химии. Один из способов познания окружающего мира, основанный на объективных данных
Предмет химии. Один из способов познания окружающего мира, основанный на объективных данных Простые вещества в стране Химляндии. 8 класс
Простые вещества в стране Химляндии. 8 класс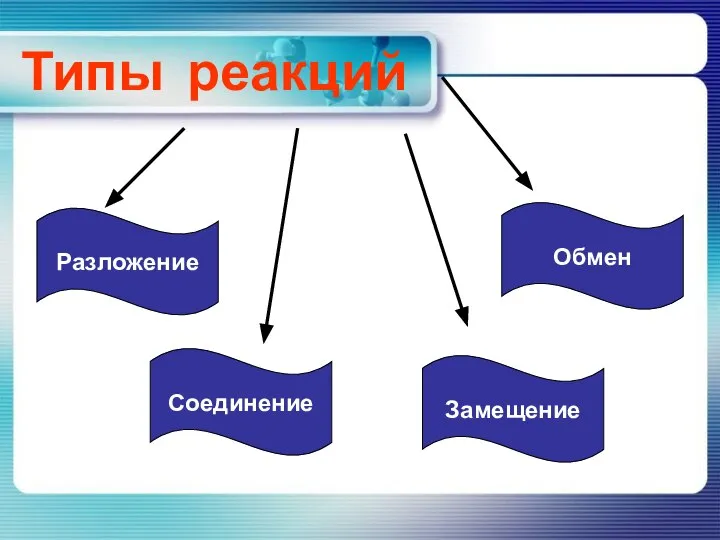 Реакции разложения
Реакции разложения