Содержание
- 2. Реакции разложения
- 3. Реакции разложения - это такие реакции, в результате которых из одного сложного вещества образуется несколько новых
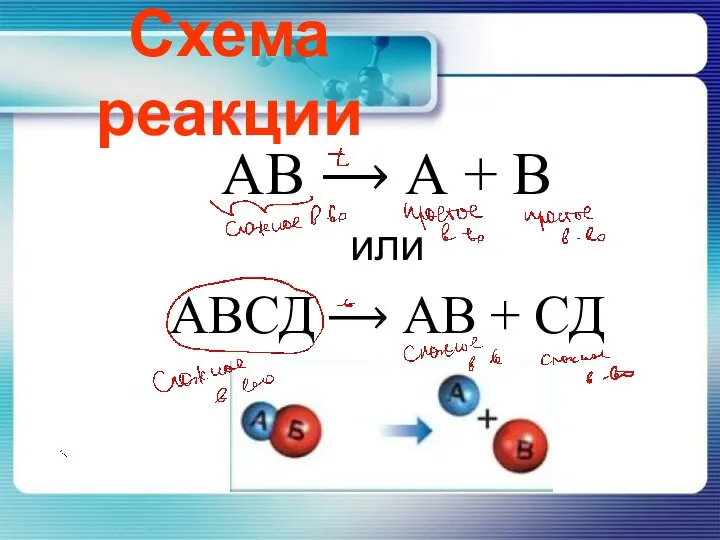
- 4. Схема реакции АВ ⟶ А + В или АВСД ⟶ АВ + СД
- 6. Типовые реакции разложения 1) Все нерастворимые основания разлагаются под действием t֯, с образованием оксида металла этой
- 7. 2) Нерастворимые кислородосодержащие соли разлагаются под действием t֯, с образованием оксида металла этой же валентности и
- 8. 3)Нерастворимая кислородосодержащая кислота (H2SiO3) разлагаются под действием t֯, с образованием оксида неметалла этой же валентности и
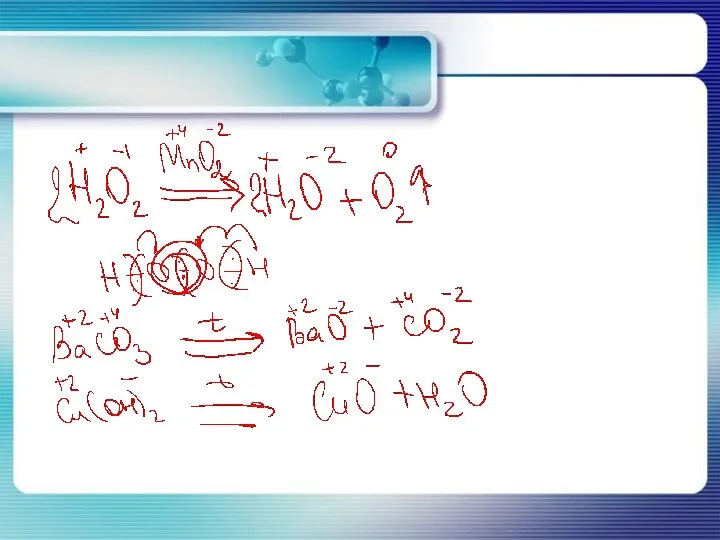
- 9. Типовые реакции разложения KMnO4 → K2MnO4 + MnO2 + O2↑ HNO3 → NO2↑ + O2↑ +
- 10. Основные понятия Катализаторы – это вещества, изменяющие скорость химической реакции, но по окончании их остающиеся качественно
- 12. Скачать презентацию







 Пластмассы. Материалы, устойчивые против агрессивой среды
Пластмассы. Материалы, устойчивые против агрессивой среды KNO3 ; Ba(OH)2 ; Na2SO4 ; Al2(SO4)3 ;
KNO3 ; Ba(OH)2 ; Na2SO4 ; Al2(SO4)3 ; Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Химия элементов
Химия элементов Окислительно-восстановительные реакции (1)
Окислительно-восстановительные реакции (1) Явление аллотропии
Явление аллотропии Реакция нейтрализации
Реакция нейтрализации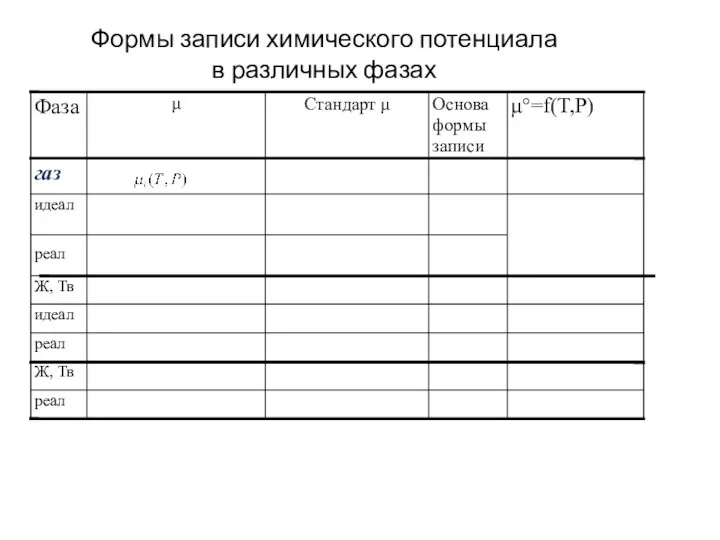 Формы записи химического потенциала в различных фазах
Формы записи химического потенциала в различных фазах Алкины
Алкины Основной закон радиоактивного распада и активность радионуклидов
Основной закон радиоактивного распада и активность радионуклидов Реакции ионного обмена составление ионных уравнений
Реакции ионного обмена составление ионных уравнений Железо и его соединения
Железо и его соединения Вспоминаем химию
Вспоминаем химию Термодинамика и теплопередача. Влажный воздух
Термодинамика и теплопередача. Влажный воздух Презентация на тему Неметаллы. Мышьяк
Презентация на тему Неметаллы. Мышьяк  Химия в еде
Химия в еде Презентация на тему Химические свойства кислот
Презентация на тему Химические свойства кислот  Электролиты и неэлектролиты. Электролитическая диссоциация
Электролиты и неэлектролиты. Электролитическая диссоциация Физические свойства металлов
Физические свойства металлов Электролитическая диссоциация
Электролитическая диссоциация Непредельные углеводороды (алкены)
Непредельные углеводороды (алкены) Кислород Общая характеристика, получение и свойства
Кислород Общая характеристика, получение и свойства Диэлектрики
Диэлектрики Водород – первый элемент в периодической таблице
Водород – первый элемент в периодической таблице Кроссворд первоначальные понятия
Кроссворд первоначальные понятия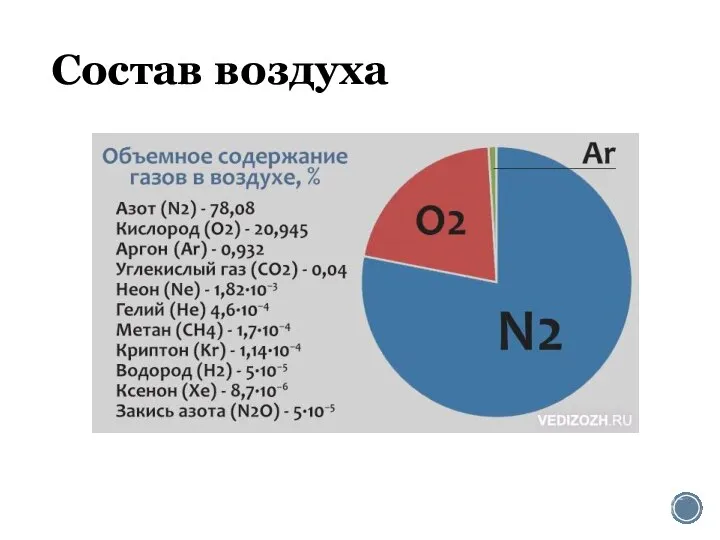 Состав воздуха. Азот
Состав воздуха. Азот Круговорот серы в природе
Круговорот серы в природе Оценивание эффективности многофункциональной присадки для бензинов
Оценивание эффективности многофункциональной присадки для бензинов