Содержание
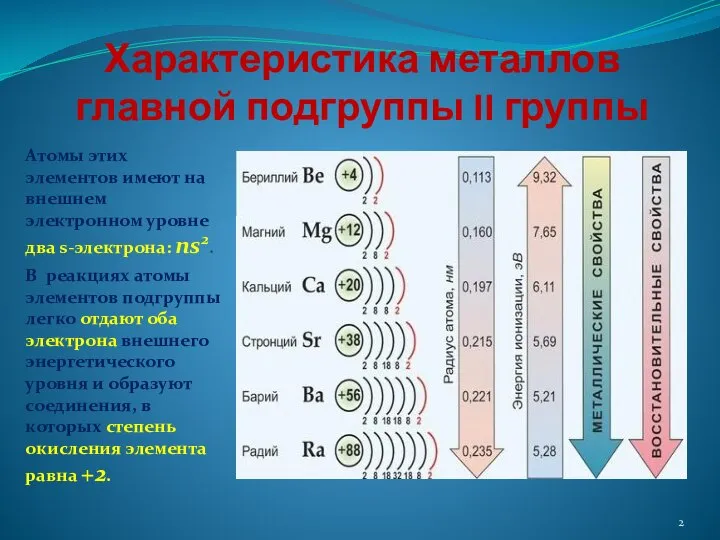
- 2. Характеристика металлов главной подгруппы II группы Атомы этих элементов имеют на внешнем электронном уровне два s-электрона:
- 3. Строение атома Это s-элементы. В виде простых веществ типичные металлы. На внешнем уровне имеют по два
- 4. Щелочноземельные металлы В главную подгруппу II группы входят бериллий Be, магний Mg, кальций Са, стронций Sr,
- 6. Получение щелочноземельных металлов Электролизом расплавов их хлоридов или термическим восстановлением их соединений: BeF2 + Mg =
- 7. Химические свойства Щелочноземельные элементы - химически активные металлы. Они являются сильными восстановителями. Из металлов этой подгруппы
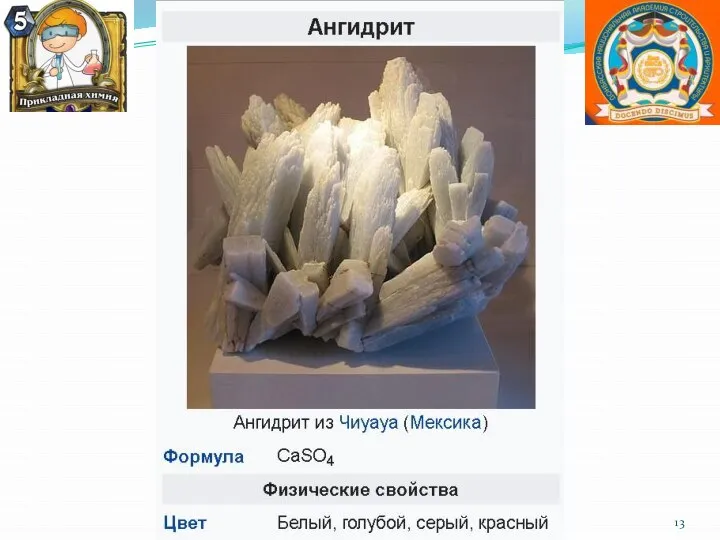
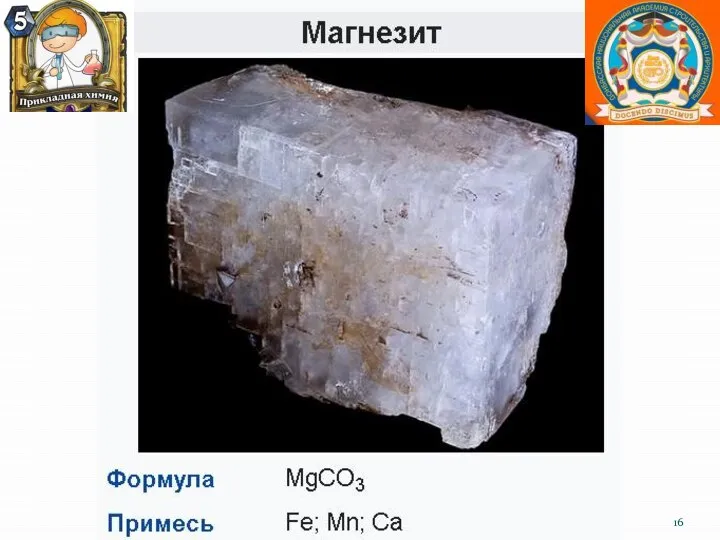
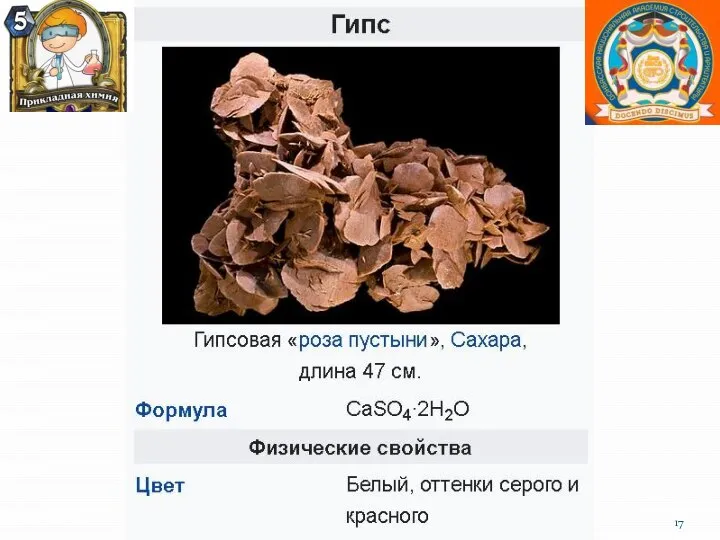
- 8. Нахождение в природе Все щёлочноземельные металлы имеются (в разных количествах) в природе. Ввиду своей высокой химической
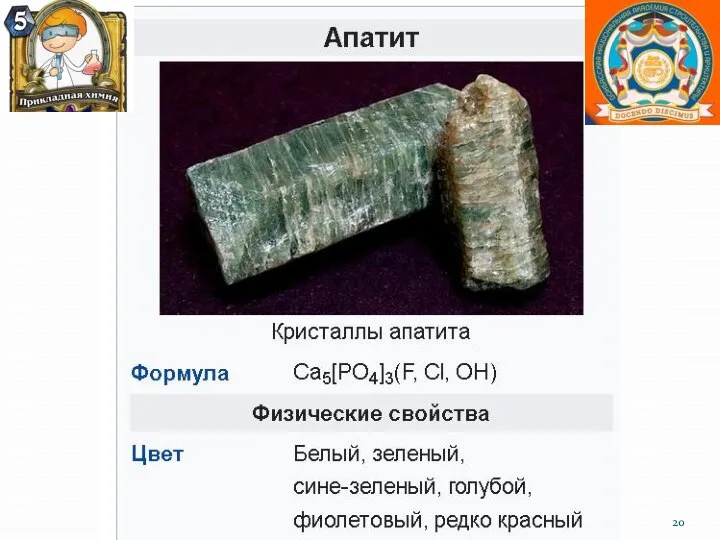
- 21. Кальций и его практическое значение. Большая часть кальция содержится в составе силикатов и алюмосиликатов различных горных
- 22. Взаимодействие с простыми веществами Все легко взаимодействуют с кислородом и серой, образуя оксиды и сульфаты: 2Be
- 23. Взаимодействие с кислотами Все взаимодействуют с хлороводородной и разбавленной серной кислотами с выделением водорода: Be +
- 24. Взаимодействие со щелочами Бериллий взаимодействует с водными растворами щелочей с образованием комплексной соли и выделением водорода:
- 25. Влияние жесткости воды на здоровье человека Повышенная жесткость воды негативно сказывается на здоровье человека при умывании.
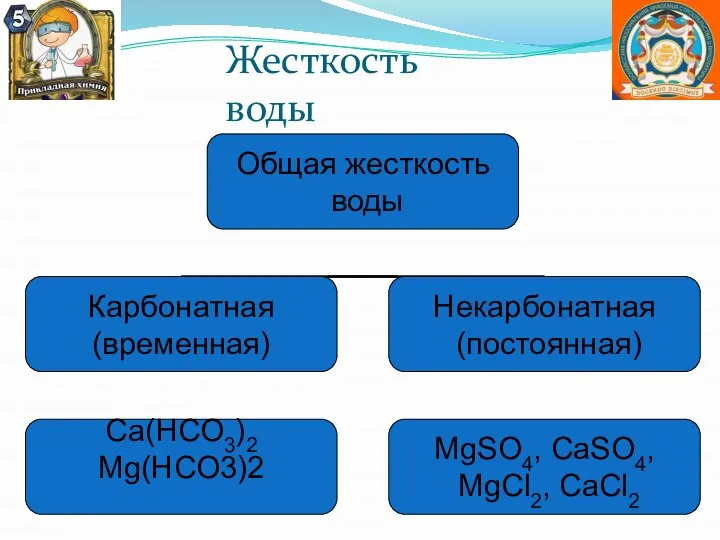
- 26. Жесткость воды
- 27. Жесткость воды Жёсткость воды - свойство воды (не мылиться, давать накипь в паровых котлах), связанное с
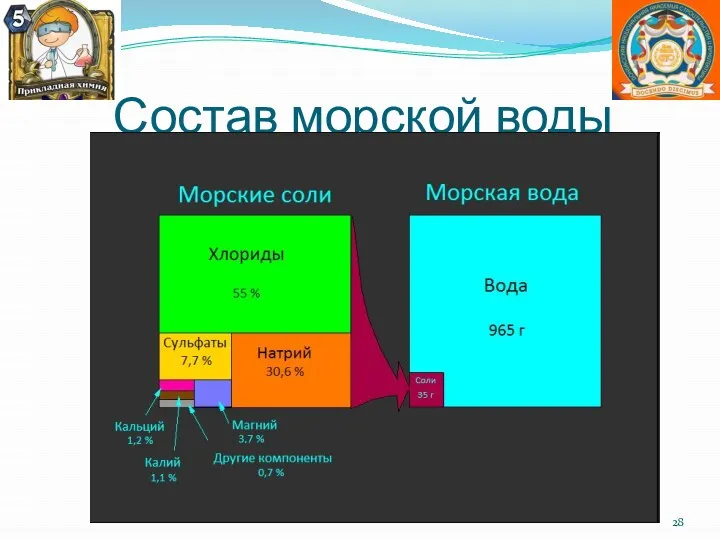
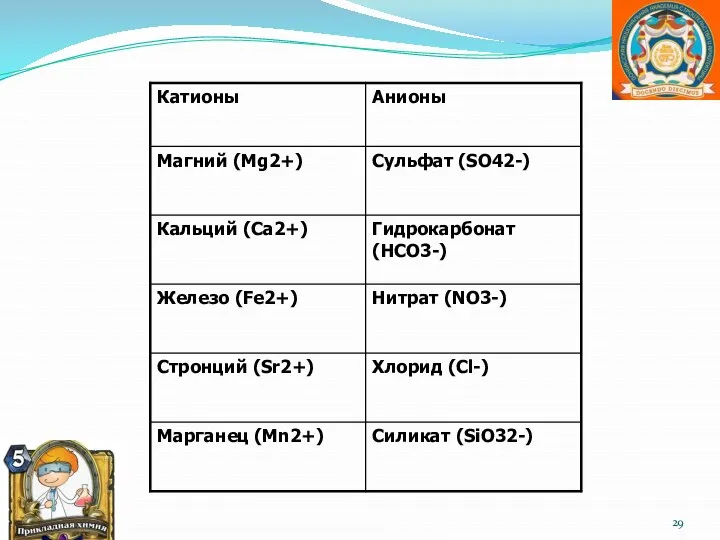
- 28. Состав морской воды
- 30. Методы устранения жесткости Для устранения карбонатной жёсткости воду кипятят. Общую жёсткость устраняют или добавлением химических веществ,
- 31. Методы умягчения воды: Реагентное умягчение воды, при этом способе очистки воды ионы Ca+2 и Mg+2 связываются
- 32. Устранение карбонатной жесткости Кипячение Са(НСО3)2 → СаСО3 ↓+ Н2О + СО2↑; Mg(НСО3)2 → MgСО3 ↓ +
- 33. Действие раствора соды Na2CO3: СaSO4 + Na2СО3 → CaСО3 ↓ + Na2SO4; MgCl2 + Na2СО3 →
- 34. О содержании железа в питьевой воде Высокое содержание железа в воде вызывает отложение осадка в трубах
- 36. Скачать презентацию

























 Elektroliz_Gidroliz
Elektroliz_Gidroliz Основания. Формулы двух амфотерных оксидов
Основания. Формулы двух амфотерных оксидов Окислительно-восстановительные реакции. Типы химических реакций
Окислительно-восстановительные реакции. Типы химических реакций Презентация на тему Химический алфавит
Презентация на тему Химический алфавит  Методы диагностики плазмы
Методы диагностики плазмы Реакции ионного обмена
Реакции ионного обмена Растворы вокруг нас
Растворы вокруг нас Классификация неорганических веществ
Классификация неорганических веществ Алмашу реакциясе
Алмашу реакциясе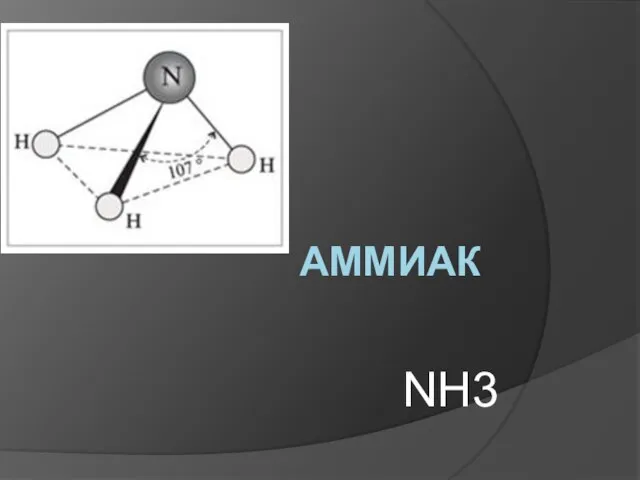 Аммиак NH3
Аммиак NH3 Презентация на тему Кристаллические решетки
Презентация на тему Кристаллические решетки  Определение качества дизельного топлива
Определение качества дизельного топлива Изменение агрегатных состояний вещества
Изменение агрегатных состояний вещества Презентация на тему Знаешь ли ты классы неорганических веществ
Презентация на тему Знаешь ли ты классы неорганических веществ 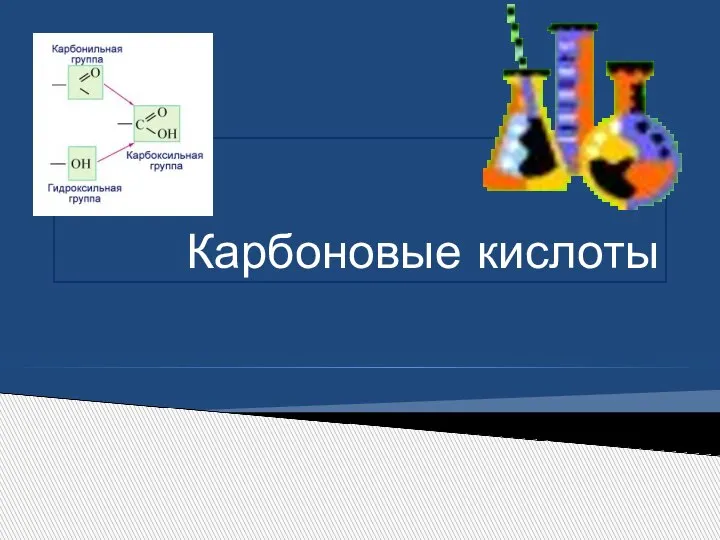 Карбоновые кислоты
Карбоновые кислоты Комментарии к выполненным заданиям по темам растворы и электролитическая диссоциация. 8 класс
Комментарии к выполненным заданиям по темам растворы и электролитическая диссоциация. 8 класс Азотосодержащие органические соединения
Азотосодержащие органические соединения Изомерия и ее виды
Изомерия и ее виды Соединения щелочных металлов
Соединения щелочных металлов Металлы и их соединения
Металлы и их соединения Химический элемент калий
Химический элемент калий Презентация на тему Подгруппа углерода
Презентация на тему Подгруппа углерода  Комплексонометрия. Способы комплексонометрического титрования
Комплексонометрия. Способы комплексонометрического титрования Амфотерные соединения Амфотерными называют соединения, которые в зависимости от условий могут быть как донорами катионов водоро
Амфотерные соединения Амфотерными называют соединения, которые в зависимости от условий могут быть как донорами катионов водоро Валентность. Составление формул по валентности
Валентность. Составление формул по валентности Массовая доля растворённого вещества
Массовая доля растворённого вещества Природный источник нефть
Природный источник нефть Химический элемент. Изотопы. Ионы
Химический элемент. Изотопы. Ионы