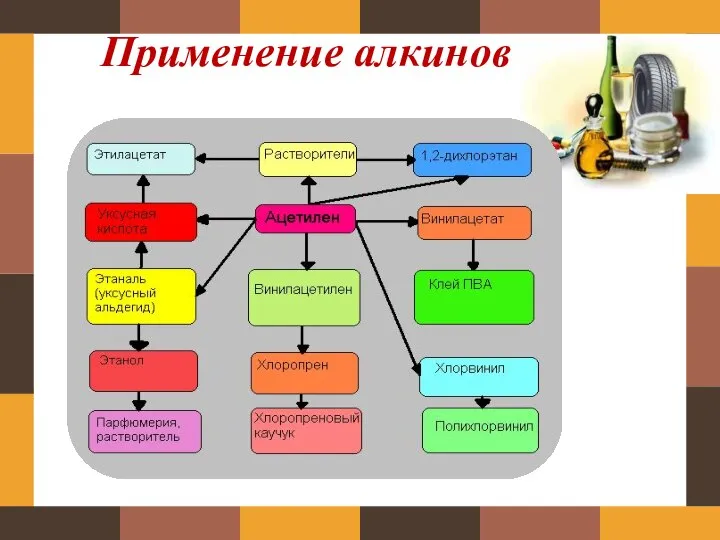
присоединяется с той стороны тройной связи,где его больше, а галоген с другой стороны связи, одна связь разрыввается:
СH3-C≡CH + HBr→CH3-CBr═CH2 1 стадия (остается двойная связь)
2-бромпропен
CH3-CBr═CH2 + HBr→CH3-CBr2-CH3 2 стадия(еще одна связь разрывается,,Н идет в торону,где его больше, а бром идет к брому)
2,2 – дибромпропан
3. Гидрирование-присоединение водорода
СH3-C≡CH +H2 →CH3-CН═CH2 1 стадия(Н идет к тройной связи)
пропен
CH3-CН═CH2 + H2 →CH3-CН2-CH3 2 стадия
пропан
4. Гидратация (реакция Кучерова)
СH3-C≡CH + H2O ⎯→ CH3−CОH
2 водорода присоединяются справа от тройной связи, а О соединяется с С двойной связью




 Исследовательский проект по химии на тему: Жесткость воды и способы ее устранения
Исследовательский проект по химии на тему: Жесткость воды и способы ее устранения Кислородсодержащие соединения азота. Оксиды азота
Кислородсодержащие соединения азота. Оксиды азота Биохимия. Основные классы соединений. Аминокислоты и Белки
Биохимия. Основные классы соединений. Аминокислоты и Белки Аймақтық мета морфизм тауж ыныстары
Аймақтық мета морфизм тауж ыныстары Степени окисления и формулы веществ
Степени окисления и формулы веществ Соли в свете теории электролитической диссоциации
Соли в свете теории электролитической диссоциации Силикатная промышленность
Силикатная промышленность Нанохімія та основи нанотехнологій
Нанохімія та основи нанотехнологій Презентация Повторение к СОЧ-10 кл (1)
Презентация Повторение к СОЧ-10 кл (1) Подгруппа углерода
Подгруппа углерода Неорганическая химия, часть 1
Неорганическая химия, часть 1 Анилин. Строение и свойства анилина
Анилин. Строение и свойства анилина Искусственные и синтетические полимеры
Искусственные и синтетические полимеры Признаки реакции
Признаки реакции ЛКМ на основе кремнийорганических соединений
ЛКМ на основе кремнийорганических соединений Химические методы количественного анализа веществ
Химические методы количественного анализа веществ Химический элемент Франций (Fr)
Химический элемент Франций (Fr) Органическая химия. Йенс Якоб Берцелиус (1779 - 1848)
Органическая химия. Йенс Якоб Берцелиус (1779 - 1848) Коррозия металлов
Коррозия металлов Приходченко ФЕР-2031
Приходченко ФЕР-2031 Кислород
Кислород Презентация на тему Великие химики
Презентация на тему Великие химики  Презентация на тему Подгруппа углерода и азота
Презентация на тему Подгруппа углерода и азота  Алюминий. Положение алюминия в периодической системе и строение его атома
Алюминий. Положение алюминия в периодической системе и строение его атома Арены. Бензол
Арены. Бензол Количество вещества. Молярная масса. Молярный объем
Количество вещества. Молярная масса. Молярный объем Химические средства защиты растений
Химические средства защиты растений Классификация неорганических веществ
Классификация неорганических веществ