Содержание
- 2. ЦО: 1.0.2.1.2 описать строение молекулы азота; Задание Изобразите диаграмму молекулы азота с помощью точек и крестов
- 3. ЦО: 10.2.1.3 знать получение, свойства газа аммиака и его раствора; Задание Аммиак проявляет восстановительные свойства, превращаясь
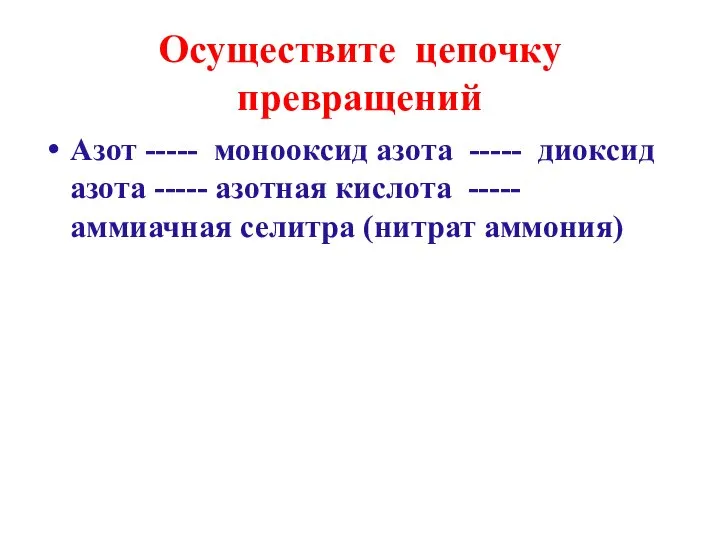
- 4. Осуществите цепочку превращений Азот ----- монооксид азота ----- диоксид азота ----- азотная кислота ----- аммиачная селитра
- 5. ЦО: 10.2.1.3 знать получение, свойства газа аммиака и его раствора; Вопросы: Назовите реагенты для получения аммиака
- 6. В промышленности фосфор получают из фосфатов электротермическим восстановлением коксом в присутствии кремнезема при температуре 1400 –
- 7. Определение нитрат-иона К раствору нитрат-иона необходимо добавить эквивалентное количество раствора щёлочи, полоску алюминиевой фольги (30 на
- 8. Решение задач Для всех: 1. При производстве аммиака получено 230 л продукта. Сколько это составляет от
- 10. Методом полуреакций уравняйте следующие окислительно - восстановительные реакции As + HNO3 = H3AsO4 + NO2 +
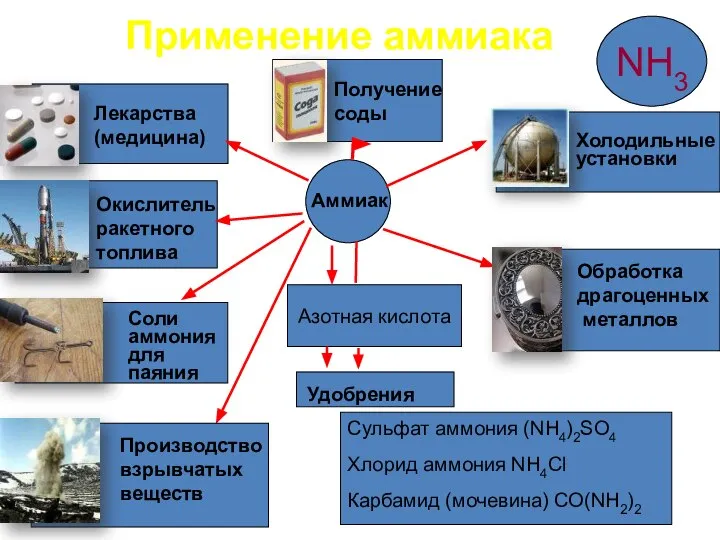
- 11. Азотная кислота Сульфат аммония (NH4)2SO4 Хлорид аммония NH4Cl Карбамид (мочевина) CO(NH2)2 Аммиак Удобрения Лекарства (медицина) Окислитель
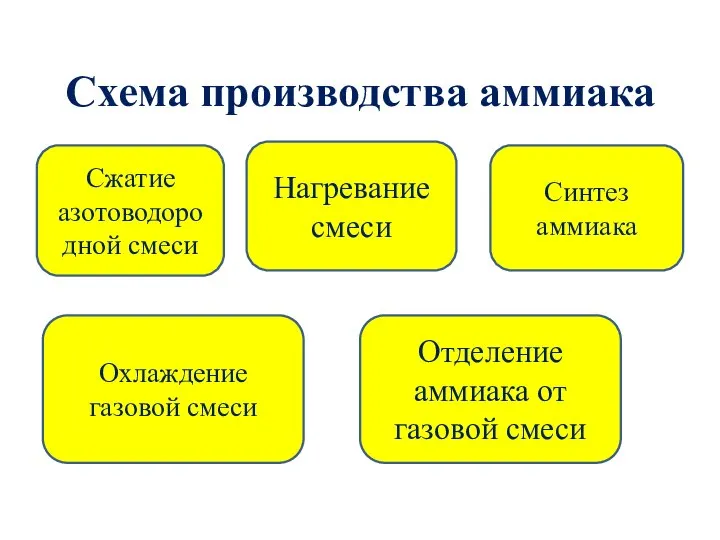
- 12. Схема производства аммиака Сжатие азотоводородной смеси Нагревание смеси Синтез аммиака Охлаждение газовой смеси Отделение аммиака от
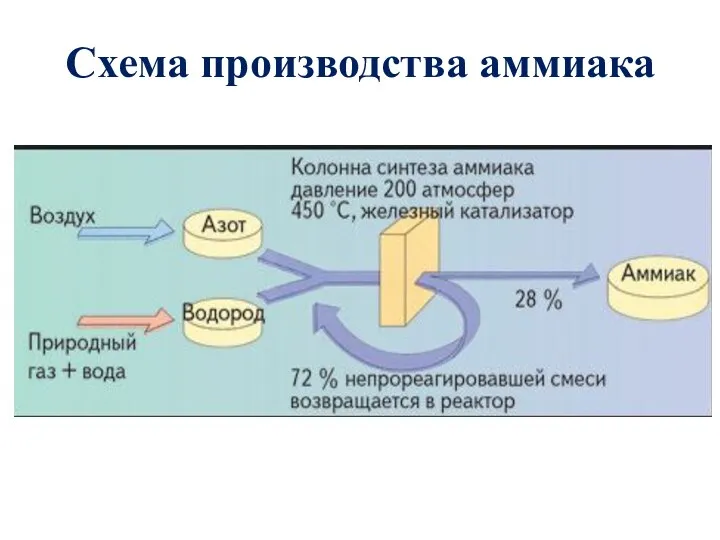
- 13. Схема производства аммиака
- 14. Основные экологические проблемы Современное производство аммиака основано на практически безотходной технологии с минимальными выбросами. Основными проблемами
- 15. Снижение выбросов дымовых газов Процесс получения аммиака происходит при высоких температурах. В печах и реакторах сжигается
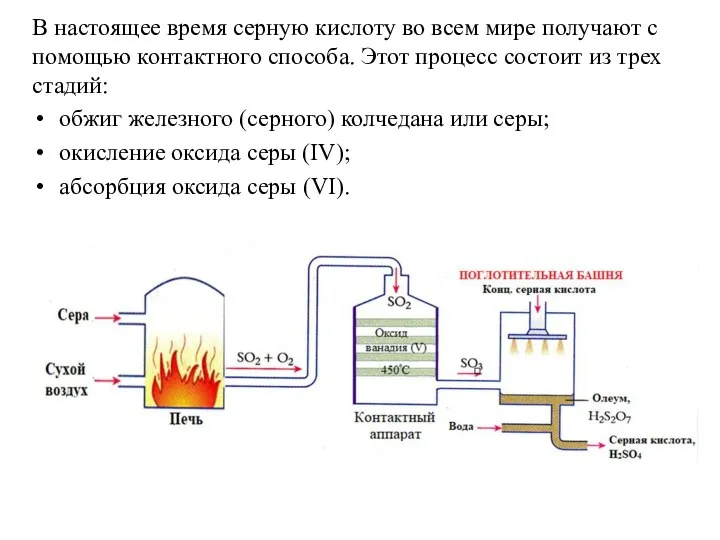
- 16. В настоящее время серную кислоту во всем мире получают с помощью контактного способа. Этот процесс состоит
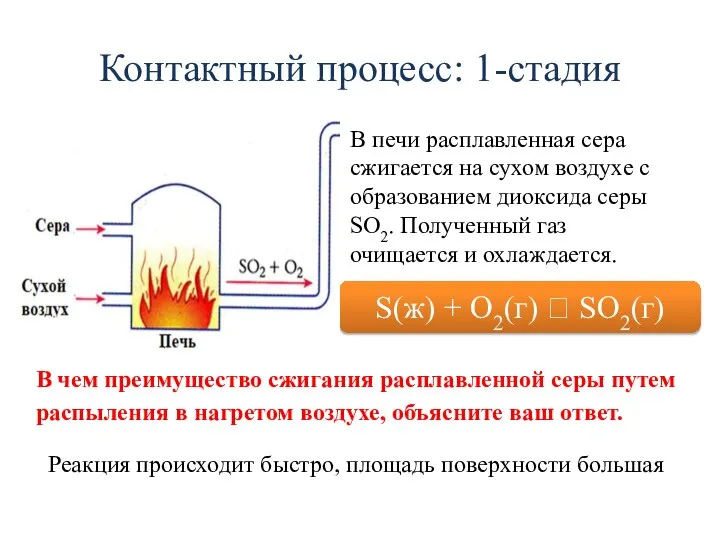
- 17. Контактный процесс: 1-стадия В печи расплавленная сера сжигается на сухом воздухе с образованием диоксида серы SO2.
- 18. Контактный процесс: 1-стадия В печи расплавленная сера сжигается на сухом воздухе с образованием диоксида серы SO2.
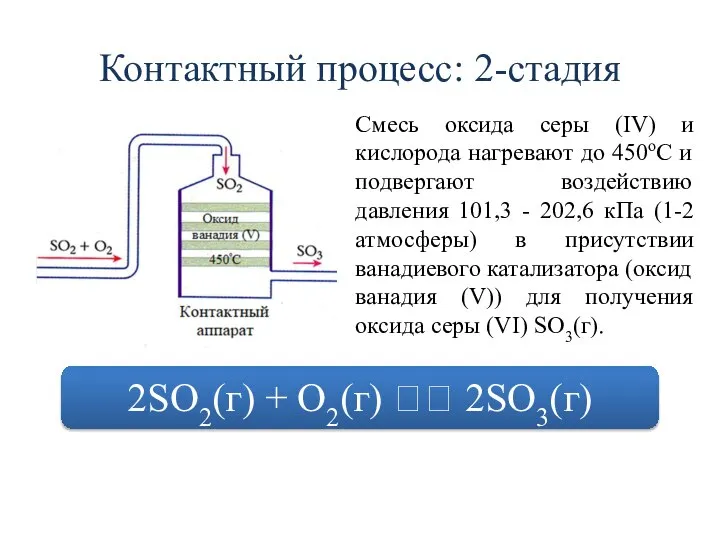
- 19. Контактный процесс: 2-стадия Смесь оксида серы (IV) и кислорода нагревают до 450oC и подвергают воздействию давления
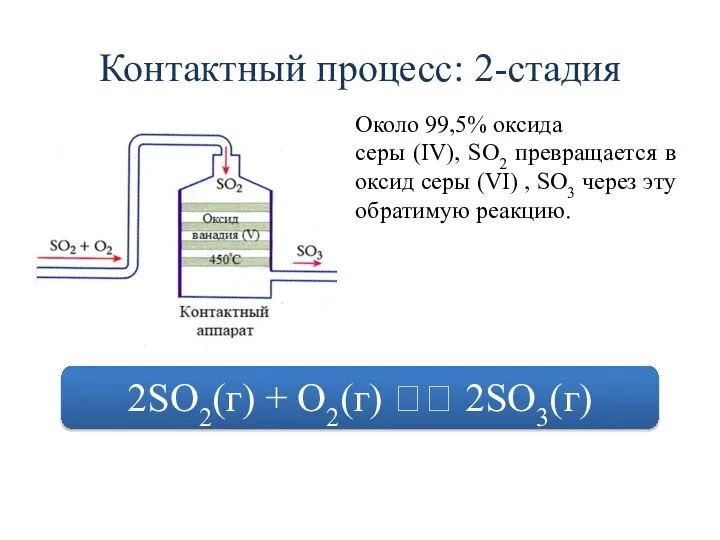
- 20. Контактный процесс: 2-стадия Около 99,5% оксида серы (IV), SO2 превращается в оксид серы (VI) , SO3
- 21. II стадия. Окисление оксида серы (IV) до оксида серы (VI) Диоксид серы + кислород (из воздуха)
- 22. II стадия. Окисление оксида серы (IV) до оксида серы (VI) Диоксид серы + кислород (из воздуха)
- 23. II стадия. Окисление оксида серы (IV) до оксида серы (VI) Диоксид серы + кислород (из воздуха)
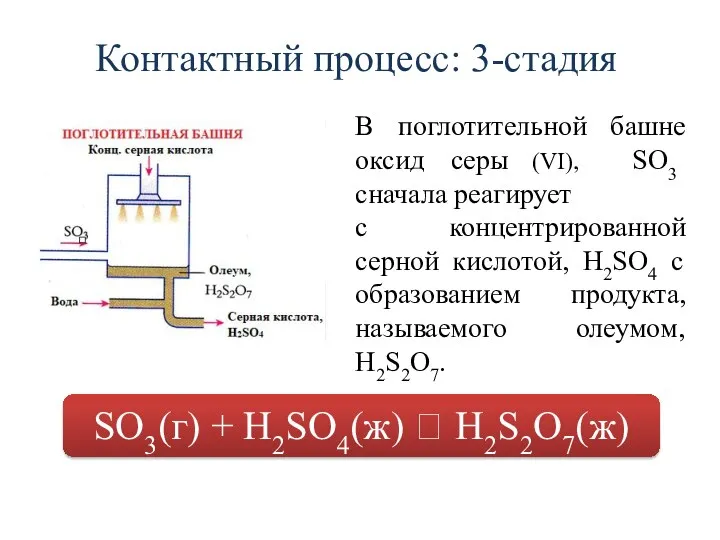
- 24. Контактный процесс: 3-стадия В поглотительной башне оксид серы (VI), SO3 сначала реагирует с концентрированной серной кислотой,
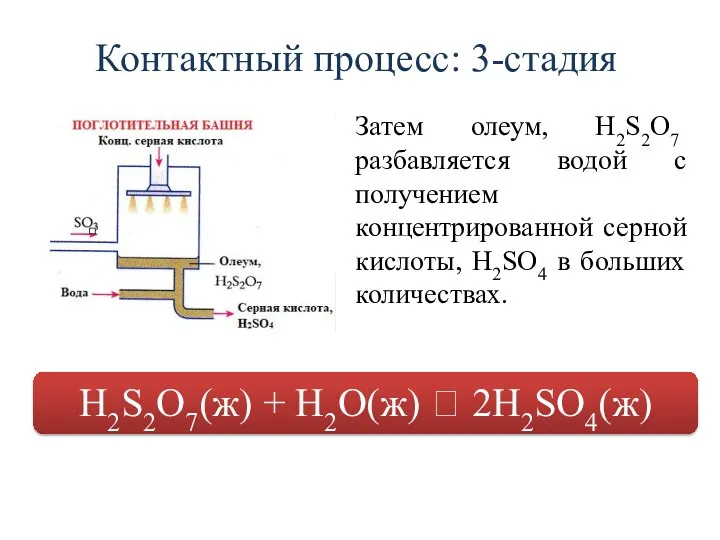
- 25. Контактный процесс: 3-стадия Затем олеум, H2S2O7 разбавляется водой с получением концентрированной серной кислоты, H2SO4 в больших
- 26. IIІ стадия. Получение серной кислоты из оксида серы (VI) Почему для поглощения оксида серы (VI) используется
- 27. Критерий оценивания: описывает основные стадии получения серной кислоты контактным способом и записывает уравнения реакций каждой стадий
- 28. Критерий оценивания: описывает основные стадии получения серной кислоты контактным способом и записывает уравнения реакций каждой стадий
- 30. Скачать презентацию

















 Щелочные металлы
Щелочные металлы Презентация на тему Изучение реакции среды в зависимости от типа гидролиза соли
Презентация на тему Изучение реакции среды в зависимости от типа гидролиза соли  Приложения для отслеживания проб ALS Geochemistry
Приложения для отслеживания проб ALS Geochemistry Вычислительные методы в химии. Что такое вычислительная (компьютерная) химия. Лекция 1
Вычислительные методы в химии. Что такое вычислительная (компьютерная) химия. Лекция 1 Химические свойства бензола. Получение, применение. Учитель биологии-химии МОУ «СОШ р.п. Озинки» Хорова Людмила Владимировна
Химические свойства бензола. Получение, применение. Учитель биологии-химии МОУ «СОШ р.п. Озинки» Хорова Людмила Владимировна Решение экспериментальных задач по теме Металлы
Решение экспериментальных задач по теме Металлы Презентация на тему Соли угольной кислоты
Презентация на тему Соли угольной кислоты  ліпіди
ліпіди Занимательная химия в 8 классе
Занимательная химия в 8 классе Кристаллическая структура вещества. Вывод формульных единиц по отношению масс элементов и по массовым долям элементов. (Урок №6)
Кристаллическая структура вещества. Вывод формульных единиц по отношению масс элементов и по массовым долям элементов. (Урок №6) Основания, их классификация и свойства в свете теории электролитической диссоциации
Основания, их классификация и свойства в свете теории электролитической диссоциации Презентация на тему Кристаллы
Презентация на тему Кристаллы  Физические и фазовые состояния полимеров
Физические и фазовые состояния полимеров Мицелла. Строение мицеллы
Мицелла. Строение мицеллы Многоядерные Арены
Многоядерные Арены Биогеотехнология
Биогеотехнология Основания. 8 класс
Основания. 8 класс Из опыта использования интерактивной доски на уроках химии
Из опыта использования интерактивной доски на уроках химии Презентация на тему Полимеры и их получение
Презентация на тему Полимеры и их получение  Соли. Состав и классификация
Соли. Состав и классификация Степень окисления
Степень окисления Строение атома
Строение атома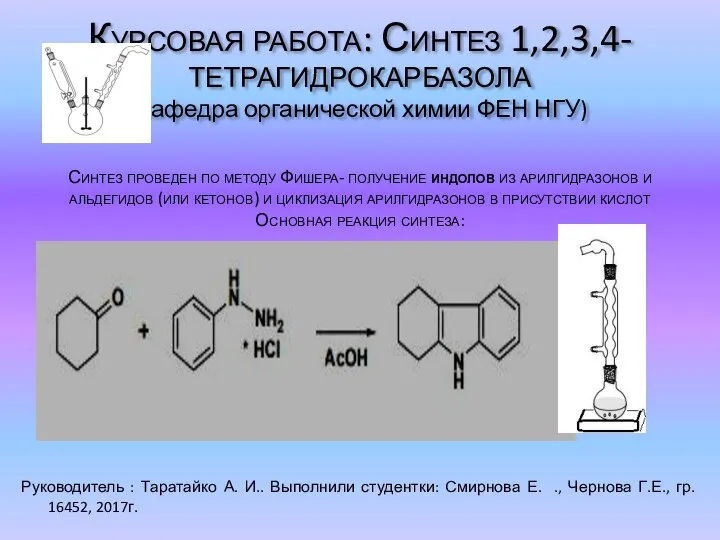 Синтез 1,2,3,4-тетрагидрокарбазола
Синтез 1,2,3,4-тетрагидрокарбазола Производство серной кислоты
Производство серной кислоты Способы получения металлов
Способы получения металлов Мышьяк (As)
Мышьяк (As)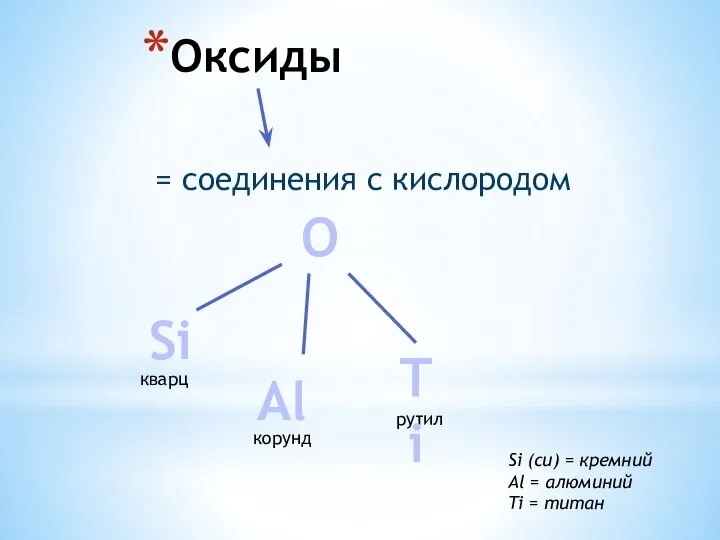 Оксиды. Кварц (SiO2). Корунд (Al2O3)
Оксиды. Кварц (SiO2). Корунд (Al2O3) Биосинтез гема
Биосинтез гема