Содержание
- 2. Шлифование поверхностей изделий На таких поверхностях не задерживается влага, лучше образуется защитная оксидная плёнка Поверхностный однороднее
- 3. «Ржа ест железо» - гласит русская народная пословица. «Коррозия – рыжая крыса, грызёт металлический лом.» Коррозия
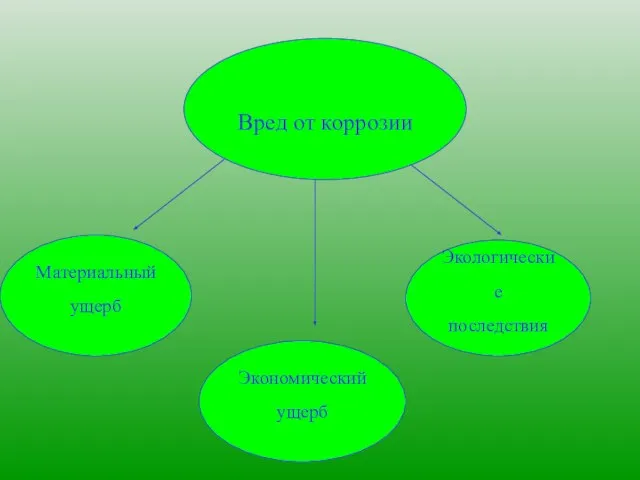
- 4. Вред от коррозии Материальный ущерб Экономический ущерб Экологические последствия
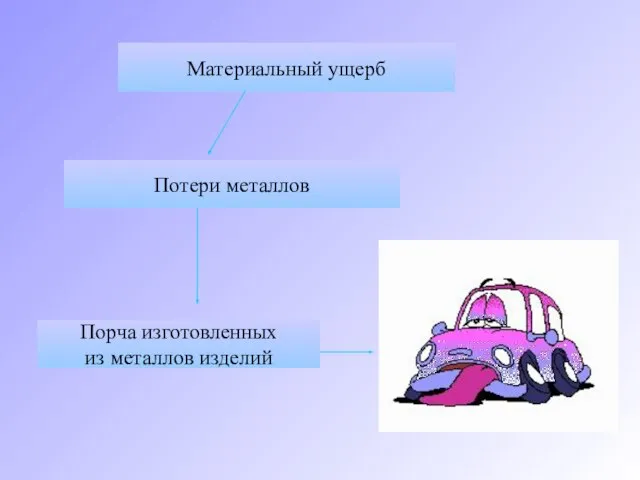
- 5. Материальный ущерб Потери металлов Порча изготовленных из металлов изделий
- 6. Затраты на ремонт, замену деталей судов, автомобилей, аппаратуры, приборов, коммуникаций во много раз превышают стоимость металла.
- 7. Утечка нефти, газов из разрушенных коррозией трубопроводов Загрязнение окружающей среды Отрицательное воздействие на здоровье людей Экологические
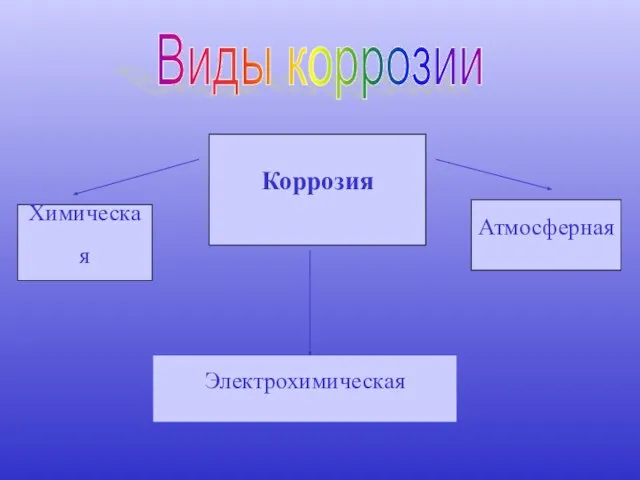
- 8. Виды коррозии Химическая Атмосферная Электрохимическая Коррозия
- 9. Химическая: под действием газов в отсутствии влаги, при действии высокой температуры.
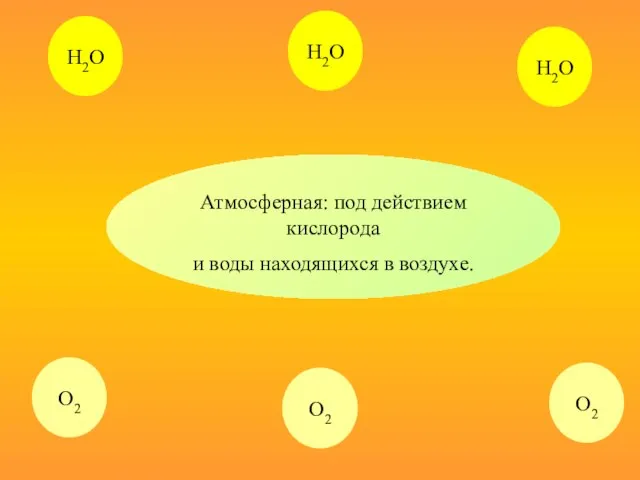
- 10. Атмосферная: под действием кислорода и воды находящихся в воздухе. Н2О Н2О О2 О2 Н2О О2
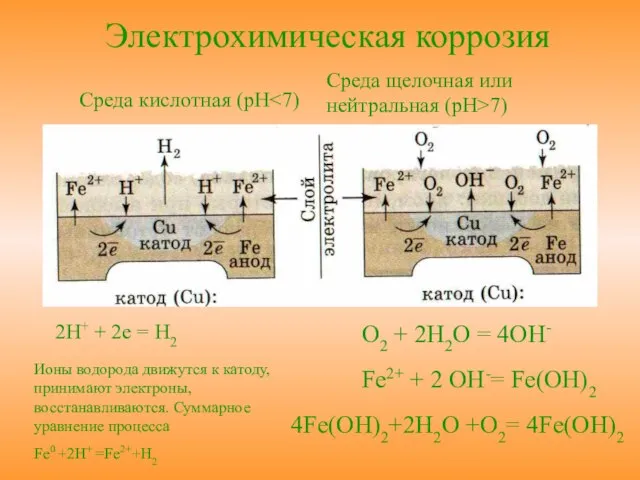
- 11. Среда щелочная или нейтральная (pH>7) Среда кислотная (pH 2H+ + 2e = H2 Ионы водорода движутся
- 12. Методы защиты металлов от коррозии
- 13. Покрытия Изоляция металла от внешней среды Неметаллические: Металлические Химические: Краски Эмали Смолы Масла Полимеры Лаки Цинкование
- 14. Применение легированных сплавов Пассивация металла Введение в состав стали легирующих элементов: Сr, Ni, AI, Mn, Mo,
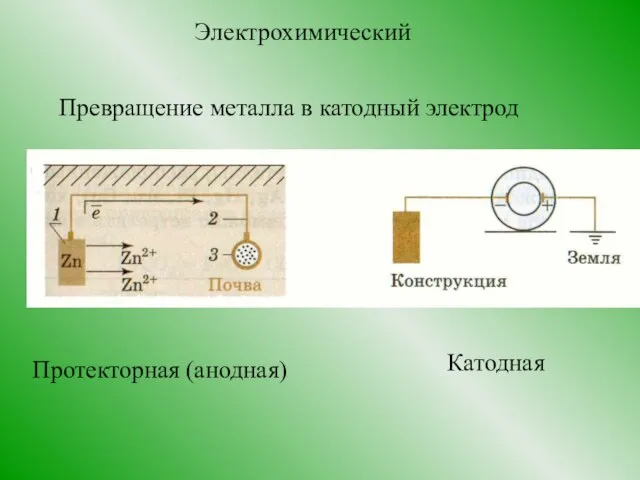
- 15. Электрохимический Превращение металла в катодный электрод Протекторная (анодная) Катодная
- 17. Скачать презентацию








 Получение формальдегида методом дегидрирования метанола
Получение формальдегида методом дегидрирования метанола Презентация на тему Простые вещества - неметаллы
Презентация на тему Простые вещества - неметаллы  Органическая химия. Подготовка к экзамену
Органическая химия. Подготовка к экзамену Потенциометрические анализаторы Поверка рН - метра
Потенциометрические анализаторы Поверка рН - метра Химия нефти и газа
Химия нефти и газа 2.Химич. м-ды колич. ан-за
2.Химич. м-ды колич. ан-за 20140111_mineraly
20140111_mineraly Алкадиены
Алкадиены Массовая доля химич элемента
Массовая доля химич элемента Типы химических реакций. Решение примеров
Типы химических реакций. Решение примеров Валентность
Валентность Nevarne snovi
Nevarne snovi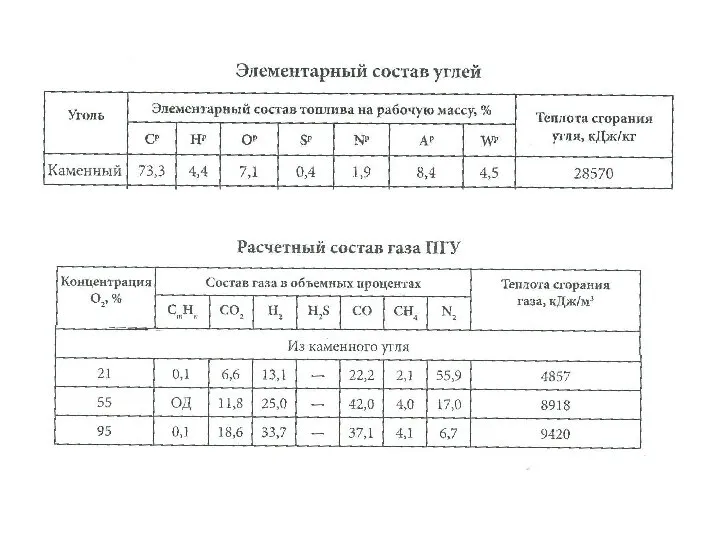 Элементарный состав углей
Элементарный состав углей Золоторудное поле Дуэт
Золоторудное поле Дуэт Кислотно-основные равновесия в растворах
Кислотно-основные равновесия в растворах Теория строения вещества. Межмолекулярные взаимодействия. Водородная связь. Специфические взаимодействия
Теория строения вещества. Межмолекулярные взаимодействия. Водородная связь. Специфические взаимодействия Степень окисления (СО) – § 18
Степень окисления (СО) – § 18 Природный и попутные нефтяные газы
Природный и попутные нефтяные газы Химия в косметике
Химия в косметике Задания на альдегиды и кетоны
Задания на альдегиды и кетоны Свойства глюкозы
Свойства глюкозы Основы молекулярно - кинетической теории
Основы молекулярно - кинетической теории Презентация на тему Правила безопасности труда в кабинете химии
Презентация на тему Правила безопасности труда в кабинете химии  Презентация на тему Знаешь ли ты классы неорганических веществ
Презентация на тему Знаешь ли ты классы неорганических веществ  Сера и её соединения
Сера и её соединения Презентация на тему Классы неорганических веществ
Презентация на тему Классы неорганических веществ  Металлом называется светлое тело, которое ковать можно
Металлом называется светлое тело, которое ковать можно Термодинамика живого объекта. Основы биоэнергетики. Лекция 2
Термодинамика живого объекта. Основы биоэнергетики. Лекция 2