Содержание
- 2. соли в свете теории электролитической диссоциации
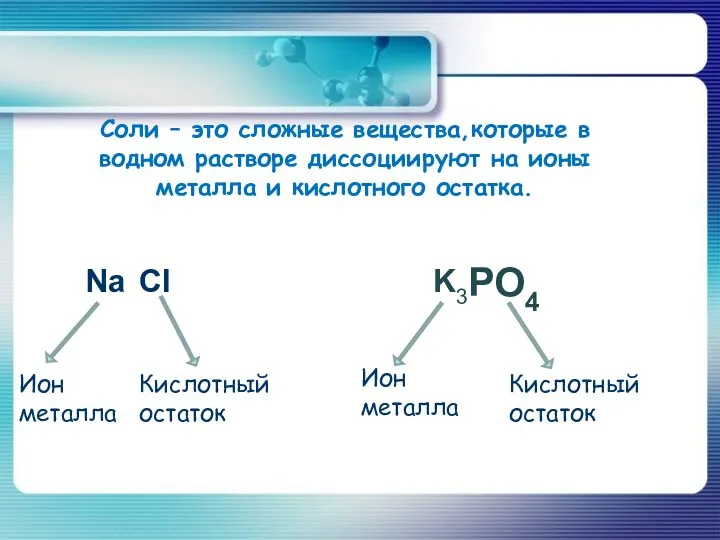
- 3. Соли – это сложные вещества,которые в водном растворе диссоциируют на ионы металла и кислотного остатка. PO4
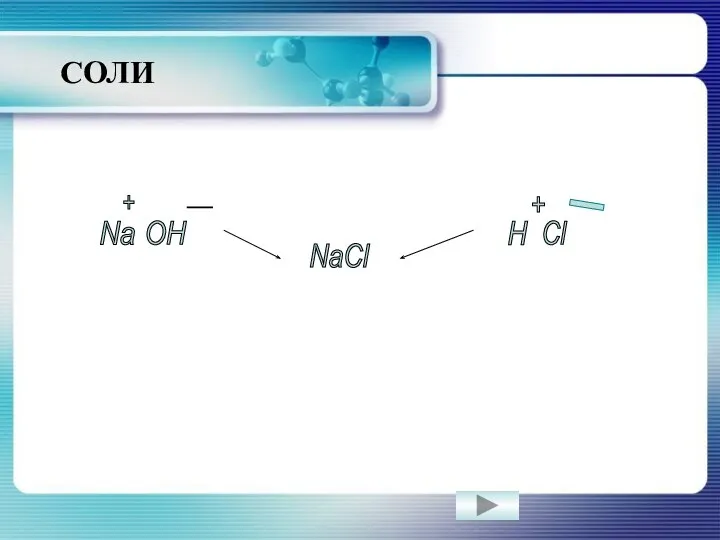
- 4. Na OH H Cl NaCl + - + _ СОЛИ
- 5. К какому классу относятся вещества: 1. MgCO3 2.NaHSO4 3. Al(OH)Cl2
- 6. Соли При диссоциации растворимых средних солей образуются катионы металлов и анионы кислотных остатков. В жидком виде
- 7. Соли Соли, которые при диссоциации образуют, кроме катиона металла, и катион водорода H+ (ион гидроксония). Такие
- 8. Соли Основные соли при диссоциации образуют, кроме кислотного остатка, ещё и гидроксид-анионы OH−: Сa(OH)Cl = Сa(OH)
- 10. Скачать презентацию





 Изомерия органических соединений. Лекция 2
Изомерия органических соединений. Лекция 2 Презентация на тему Серная кислота
Презентация на тему Серная кислота  Fosforan V wapnia Ca3(PO4)2
Fosforan V wapnia Ca3(PO4)2 Твердые электролиты
Твердые электролиты Обратимость химических реакций. Химическое равновесие
Обратимость химических реакций. Химическое равновесие Алкены
Алкены Жиры – биологически важные органические соединения
Жиры – биологически важные органические соединения Осаждение нитрида кремния
Осаждение нитрида кремния Составление ионных уравнений
Составление ионных уравнений Свойства кремниевой кислоты и области применения силикатов
Свойства кремниевой кислоты и области применения силикатов Алкины
Алкины Валентность. Валентные возможности атомов
Валентность. Валентные возможности атомов Теория электролитической диссоциации. Ионные уравнения. Задания
Теория электролитической диссоциации. Ионные уравнения. Задания Получение бутандиола, как способ переработки природного газа
Получение бутандиола, как способ переработки природного газа Химические вещества парабены
Химические вещества парабены Сложные эфиры и жиры
Сложные эфиры и жиры Презентация на тему Фенол и его свойства
Презентация на тему Фенол и его свойства  Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Презентация на тему Все о спиртах
Презентация на тему Все о спиртах  Структура периодической таблицы
Структура периодической таблицы Презентация на тему Химические средства гигиены и косметика
Презентация на тему Химические средства гигиены и косметика  Ключевые реакции и регуляторные ферменты начальных этапов углеводного обмена
Ключевые реакции и регуляторные ферменты начальных этапов углеводного обмена Дисперсные системы. Лекция №7
Дисперсные системы. Лекция №7 Реакции обмена. Типы химических реакций
Реакции обмена. Типы химических реакций Атомы химических элементов
Атомы химических элементов Вероятность протекания химических реакций
Вероятность протекания химических реакций Полезные ископаемые
Полезные ископаемые _Периодический закон. Распределение электронов по энергетическим уровням и подуровням (1)
_Периодический закон. Распределение электронов по энергетическим уровням и подуровням (1)