Содержание
- 2. СОДЕРЖАНИЕ Ученые, получившие алюминий Характеристика элемента - алюминия Нахождение в природе Физические свойства Химические свойства Применение
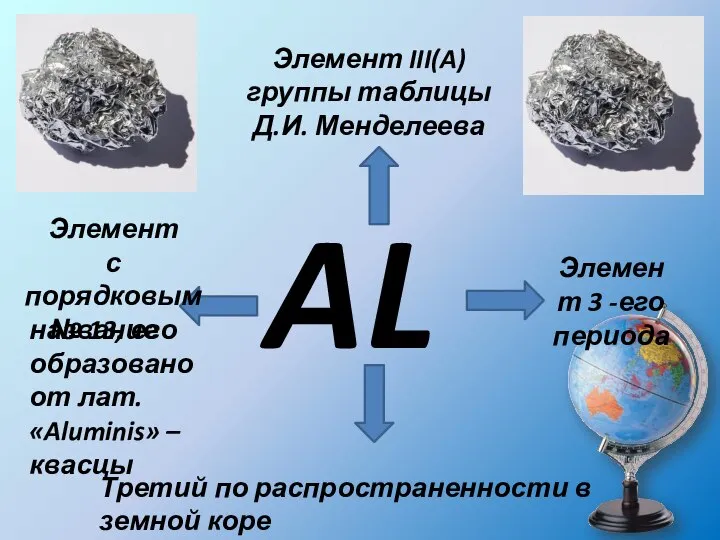
- 3. AL Элемент III(A) группы таблицы Д.И. Менделеева Элемент с порядковым № 13, его Элемент 3 -его
- 4. Датский физик Ганс Эрстед (1777-1851) Впервые алюминий был получен им в 1825 году действием амальгамы калия
- 5. Современное получение алюминия Современные метод получения был разработан независимо друг от друга: американцем Чарльзом Холлом и
- 6. Будучи студентом Оберлинского колледжа, он узнал, что можно разбогатеть и получить благодарность человечества, если изобрести способ
- 7. Поль Эру (1863-1914) – французский инженер - химик В 1889 году открыл алюминиевый завод во Фроне
- 8. Алюминий 1. Из истории открытия Главная Далее В период открытия алюминия - металл был дороже золота.
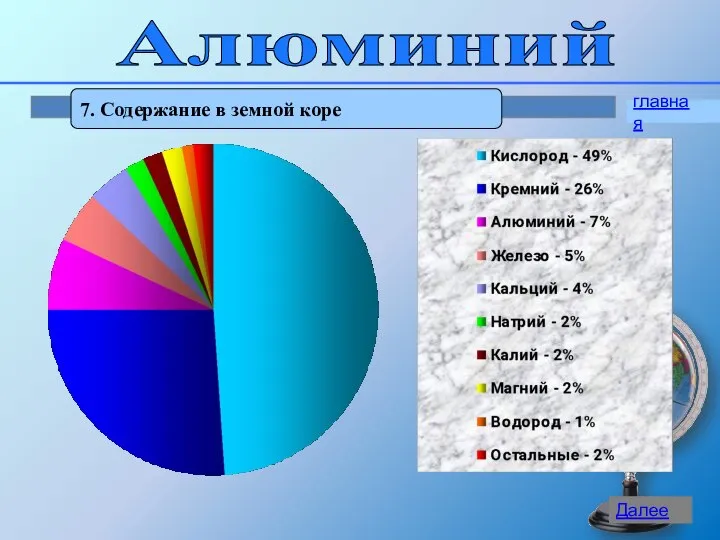
- 9. Алюминий 7. Содержание в земной коре главная Далее
- 10. Нахождение в природе Важнейшим на сегодня минералом алюминия является боксит Основной химический компонент боксита - глинозем
- 11. Алюминий 4. Физические свойства главная Далее
- 12. Алюминий 7. Нахождение в природе главная Далее
- 13. Алюминий главная Вставьте пропущенные слова Алюминий - элемент III группы, главной подгруппы. Заряд ядра атома алюминия
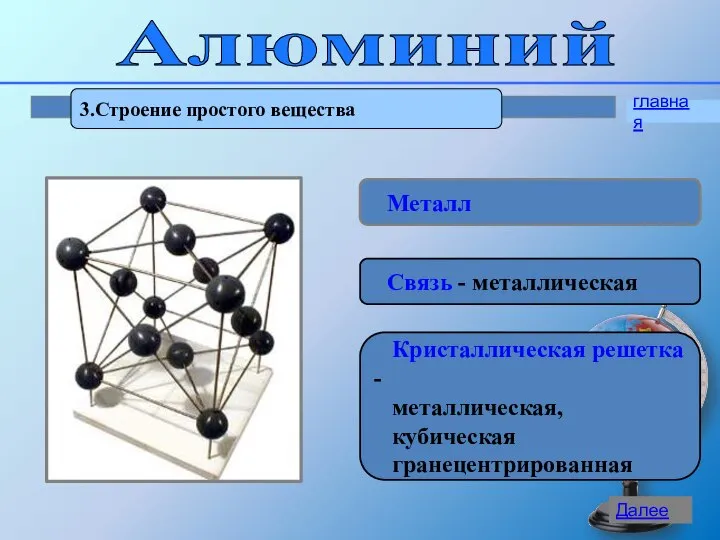
- 14. Алюминий 3.Строение простого вещества Металл Связь - металлическая Кристаллическая решетка - металлическая, кубическая гранецентрированная главная Далее
- 15. Алюминий 2. Электронное строение 27 Аl +13 0 2e 8e 3e 1s2 2s2 2p6 3s2 3p1
- 16. Алюминий 6. Химические свойства 4Аl + 3O2 = 2Al2O3 t 2Al + 3S = Al2S3 C
- 18. Скачать презентацию












 Атом. Изотопы
Атом. Изотопы Растворы. Лекция 7
Растворы. Лекция 7 Синтетические материалы
Синтетические материалы Электролиз воды
Электролиз воды Галогены
Галогены Углеводы
Углеводы Презентация на тему Стекло. История открытия, получение, применение
Презентация на тему Стекло. История открытия, получение, применение  Чистые вещества и смеси
Чистые вещества и смеси Растворы, растворимость
Растворы, растворимость Химические волокна. Урок 1-2
Химические волокна. Урок 1-2 Фракционный состав нефти. Химический состав нефти
Фракционный состав нефти. Химический состав нефти Структура периодической системы химических элементов
Структура периодической системы химических элементов Презентация на тему Амины
Презентация на тему Амины  Вуглеводи. Групи
Вуглеводи. Групи Материаловедение. Строение металлических материалов. Металлические сплавы
Материаловедение. Строение металлических материалов. Металлические сплавы Разработка методов синтеза гомогенных катализаторов оксосинтеза бутиловых спиртов
Разработка методов синтеза гомогенных катализаторов оксосинтеза бутиловых спиртов Способы получения металлов
Способы получения металлов Классификация и номенклатура неорганических соединений
Классификация и номенклатура неорганических соединений Вычислительные методы в химии. Что такое вычислительная (компьютерная) химия. Лекция 1
Вычислительные методы в химии. Что такое вычислительная (компьютерная) химия. Лекция 1 Стратегия обучения решению задач по химии
Стратегия обучения решению задач по химии Алкадиены, каучуки
Алкадиены, каучуки Строение атома. История открытия атома
Строение атома. История открытия атома Химический состав продуктов питания
Химический состав продуктов питания 9_OSNOVY_KOLANALIZA
9_OSNOVY_KOLANALIZA Полімери. Пінополістирол
Полімери. Пінополістирол Окислительно-восстановительные реакции с электронной точки зрения
Окислительно-восстановительные реакции с электронной точки зрения Классификация неорганических веществ
Классификация неорганических веществ Презентация на тему "Водород"
Презентация на тему "Водород"