Содержание
- 2. ЦЕЛЬ: Изучить: Понятие о непредельных углеводородах. Характеристику тройной связи. Изомерию и номенклатуру алкинов. Физические свойства. Получение
- 3. ПОНЯТИЕ ОБ АЛКИНАХ Алкины – углеводороды, содержащие в молекуле одну тройную связь между атомами углерода, а
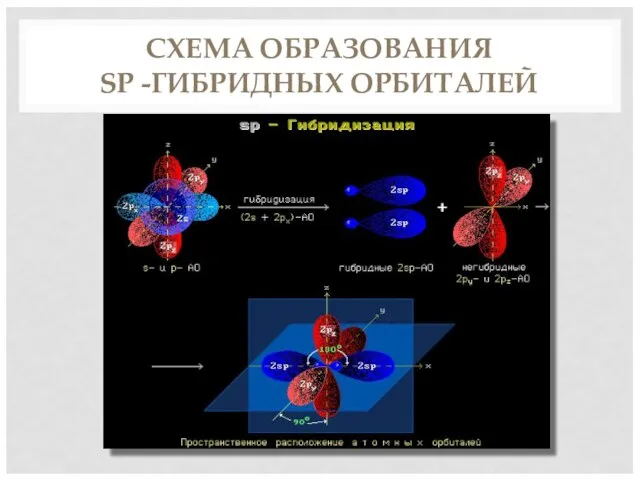
- 4. ХАРАКТЕРИСТИКА ТРОЙНОЙ СВЯЗИ Вид гибридизации – sp Валентный угол – 180 Длина связи С = С
- 5. СХЕМА ОБРАЗОВАНИЯ SP -ГИБРИДНЫХ ОРБИТАЛЕЙ
- 6. ГОМОЛОГИЧЕСКИЙ РЯД АЛКИНОВ C2H2 C3H4 C4H6 C5H8 C6H10 C7H12 Этин Пропин Бутин Пентин Гексин Гептин Что
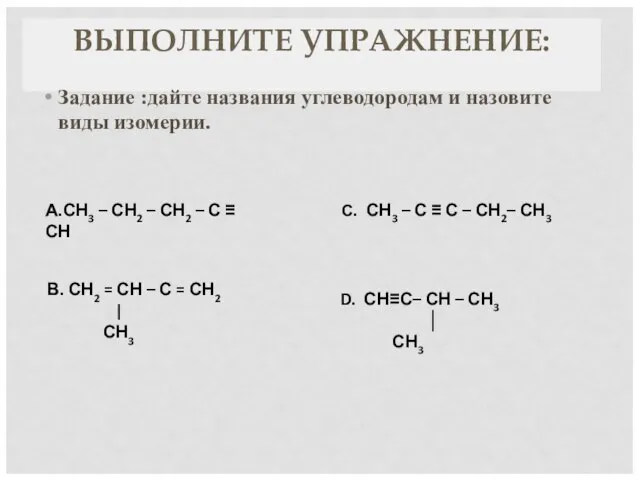
- 7. ВЫПОЛНИТЕ УПРАЖНЕНИЕ: Задание «Третий лишний». Докажите, что выбранный вами «лишний» углеводород отличается от других: 1. С4Н6
- 8. Изомерия алкинов Структурная изомерия 1. Изомерия положения тройной связи (начиная с С4Н6): СН ≡С−СН2−СН3 СН3−С≡С−СН3 бутин-1
- 9. А.СН3 – СН2 – СН2 – С ≡ СН С. СН3 – С ≡ С –
- 10. ФИЗИЧЕСКИЕ СВОЙСТВА 1. Температуры кипения и плавления алкинов, так же как и алкенов, закономерно повышаются при
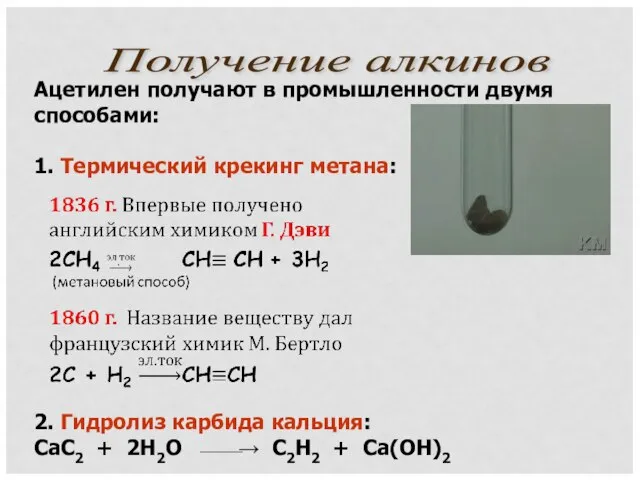
- 11. Ацетилен получают в промышленности двумя способами: 1. Термический крекинг метана: 2. Гидролиз карбида кальция: CaC2 +
- 12. ХИМИЧЕСКИЕ СВОЙСТВА АЛКИНОВ Химические свойства ацетилена и его гомологов в основном определяются наличием в их молекулах
- 13. РЕАКЦИИ ПРИСОЕДИНЕНИЯ 1. Галогенирование Обесцвечивание бромной воды является качественной реакцией на все непредельные углеводороды 2. Гидрогалогенирование.
- 14. ОКИСЛЕНИЕ Ацетилен и его гомологи окисляются перманганатом калия с расщеплением тройной связи и образованием карбоновых кислот:
- 15. ГОРЕНИЕ АЦЕТИЛЕНА При сгорании (полном окислении) ацетилена выделяется большое количества тепла: HC≡CH + 2О2 ⎯→ 2СО2
- 16. РЕАКЦИИ ЗАМЕЩЕНИЯ При взаимодействии ацетилена (или R−C≡C−H) с аммиачными растворами оксида серебра выпадают осадки нерастворимых ацетиленидов:
- 17. РЕАКЦИЯ ПОЛИМЕРИЗАЦИИ Димеризация под действием водного раствора CuCl и NH4Cl: НC≡CH + НC≡CH ⎯→ Н2C=CH−C≡CH (винилацетилен)
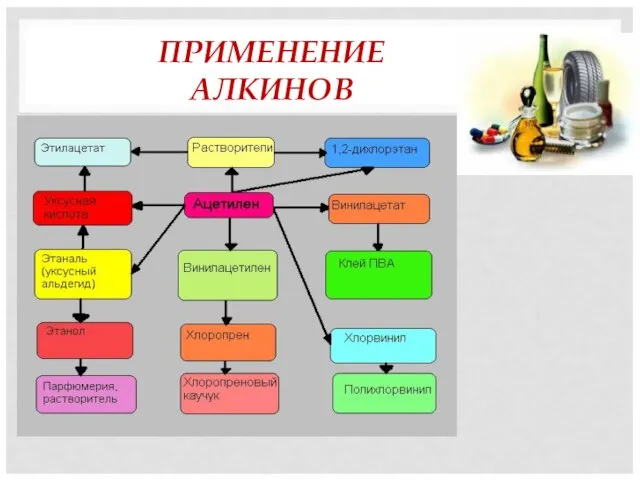
- 18. ПРИМЕНЕНИЕ АЛКИНОВ
- 19. ДОМАШНЕЕ ЗАДАНИЕ 1. Дано вещество: СН3 | СН3- С - СН2-С≡СН | СН3 название: 2 –
- 21. Скачать презентацию














 Основные соединения кальция и их применение – вчера, сегодня, завтра.
Основные соединения кальция и их применение – вчера, сегодня, завтра. Клуб юных химиков. Школа №3
Клуб юных химиков. Школа №3 Аморфные и кристаллические вещества
Аморфные и кристаллические вещества Материаловедение
Материаловедение Классификация неорганических веществ
Классификация неорганических веществ Степень окисления
Степень окисления Перспективы использования микроволнового излучения в органической химии
Перспективы использования микроволнового излучения в органической химии Оксиды
Оксиды Тест по теме Основные классы неорганических соединений
Тест по теме Основные классы неорганических соединений Защитить кабель. Задача 9
Защитить кабель. Задача 9 Синтетические высокомолекулярные органические вещества
Синтетические высокомолекулярные органические вещества Органическая химия
Органическая химия Презентация на тему Полимеразная цепная реакция (ПЦР)
Презентация на тему Полимеразная цепная реакция (ПЦР) 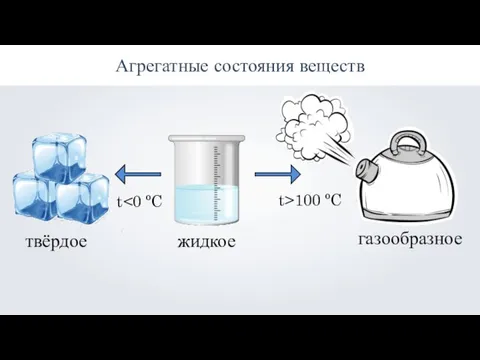 Агрегатные состояния веществ: твёрдое, жидкое, газообразное
Агрегатные состояния веществ: твёрдое, жидкое, газообразное Реакции замещения
Реакции замещения Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Тема урока: «Серная кислота» 9 класс
Тема урока: «Серная кислота» 9 класс Классы неорганических соединений
Классы неорганических соединений Общая характеристика элементов группы, главной подгруппы
Общая характеристика элементов группы, главной подгруппы Газообразные дисперсные системы (Аэрозоли)
Газообразные дисперсные системы (Аэрозоли) Кислоты в химии
Кислоты в химии Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Органическая химия: Жиры
Органическая химия: Жиры Органическая химия. Введение
Органическая химия. Введение Долговечность пластмасс
Долговечность пластмасс Карбоновые кислоты
Карбоновые кислоты Химические свойства
Химические свойства Массовые доли веществ задачи
Массовые доли веществ задачи