Слайд 2План урока:
Строение молекулы серной кислоты
Физические свойства
Химические свойства
Получение
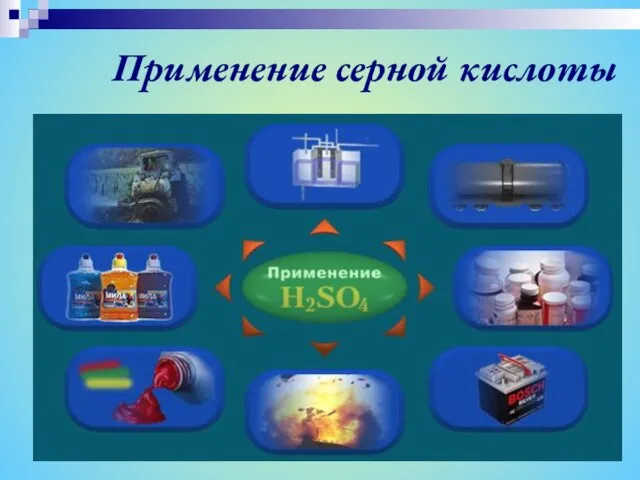
Применение

Слайд 3Строение молекулы серной кислоты
H2SO4 - молекулярная формула
Вопросы:
Простое или сложное вещество?
Какова валентность атомов:

H, S, O?
Какой тип химических связей в веществе?
Какой атом более электроотрицательный?
К какому атому смещена электронная плотность?
Слайд 4Физические свойства серной кислоты
H2SO4
Ответьте на вопросы:
Каково агрегатное состояние серной кислоты?
Хорошо ли она

смешивается с водой?
Серная кислота легче, или тяжелее воды?
Что произойдет, если прилить воду к кислоте?
5. Какие правила техники безопасности нужно помнить при работе с серной кислотой?
Слайд 5Химические свойства разбавленной кислоты
Дописать уравнения реакций:
Взаимодействие с металлами:
H2SO4+Mg->
Взаимодействие с основными и

амфотерными оксидами:
H2SO4+Na2O->
Взаимодействие с основаниями:
H2SO4+KOH->
Взаимодействие с солями:
H2SO4+BaCL2->
Слайд 6Химические свойства концентрированной кислоты:
1.Сильный окислитель. Обугливает органические вещества .
С12Н22О11------>12С+11Н2О
2. С

водой образует гидраты:
H2SO4+nH2O?H2SO4*nH2O
3.Регирует почти со всеми металлами:
Cu+2H2SO4?CuSO4+SO2+2H2O
Слайд 7Взаимодействие концентрированной
серной кислоты с металлами

Слайд 8Соли серной кислоты
Предложите названия следующим веществам .
Каково их применение?

Слайд 9Получение серной кислоты в промышленности
Осуществить цепочку превращения:
FeS2?SO2?SO3?H2SO4
По учебнику самостоятельно
изучить получение

серной
кислоты в промышленности.
Обсудите полученные знания
с соседом по парте.
Демонстрация эксперимента
получения серной кислоты в
лаборатории.








 Аминокислоты. Викторина
Аминокислоты. Викторина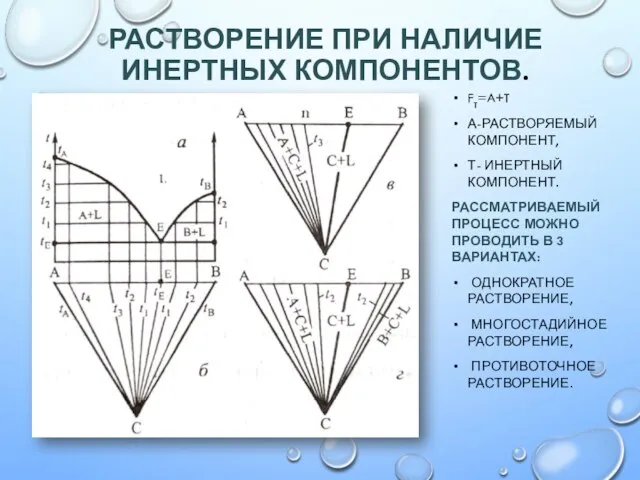 Растворение при наличии инертных компонентов
Растворение при наличии инертных компонентов Полимеры. Виды полимеров
Полимеры. Виды полимеров Обмен липидов
Обмен липидов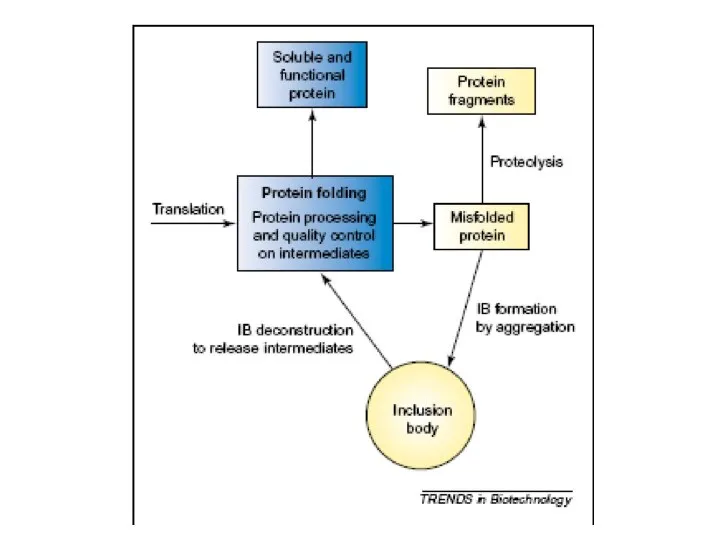 Рефолдинг миниантител
Рефолдинг миниантител Сложные вещества. Основания
Сложные вещества. Основания Коррозия. способы защиты от коррозии
Коррозия. способы защиты от коррозии e169ef73a24f42198b95276fd042e8b8
e169ef73a24f42198b95276fd042e8b8 Актуализация знаний. Закон Авогадро. Молярный объем газов (8 класс)
Актуализация знаний. Закон Авогадро. Молярный объем газов (8 класс) Галогеноалканы: получение, свойства и применение
Галогеноалканы: получение, свойства и применение Техника безопасности на уроках химии
Техника безопасности на уроках химии Типичные ошибки, допускаемые учащимися при выполнении задания повышенного уровня сложности С-5 ЕГЭ по химии
Типичные ошибки, допускаемые учащимися при выполнении задания повышенного уровня сложности С-5 ЕГЭ по химии Химический состав продуктов питания
Химический состав продуктов питания Классификация неорганических веществ
Классификация неорганических веществ Спирты
Спирты Повторение классов соединений. Составление формул по названиям
Повторение классов соединений. Составление формул по названиям Модель Томпсона. Модель Резерфорда
Модель Томпсона. Модель Резерфорда Оксиды. Классификация и химические свойства
Оксиды. Классификация и химические свойства Синтез оксида меди и йодида меди для формирования буферных слоев для ГОНП
Синтез оксида меди и йодида меди для формирования буферных слоев для ГОНП Пищевые кислоты
Пищевые кислоты Презентация на тему Лайнус Полинг
Презентация на тему Лайнус Полинг  9_OSNOVY_KOLANALIZA
9_OSNOVY_KOLANALIZA Термодинамика
Термодинамика Спазган: применение, форма, свойства, состав
Спазган: применение, форма, свойства, состав Применение арт-технологии на уроках химии Обобщение опыта педагогической деятельности МОУ СОШ № 14 город Мончегорск Мурманск
Применение арт-технологии на уроках химии Обобщение опыта педагогической деятельности МОУ СОШ № 14 город Мончегорск Мурманск Классификация химических реакций
Классификация химических реакций Презентация по Химии "Электрохимический ряд напряжений металлов. Общие химические свойства металлов"
Презентация по Химии "Электрохимический ряд напряжений металлов. Общие химические свойства металлов"  Презентация на тему Природные источники углеводородов и их переработка
Презентация на тему Природные источники углеводородов и их переработка