Слайд 2Дисциплина Химия.
Общая химия
Тема. Атом. Ядро и электронная оболочка. Изотопы
Строение электронных оболочек

атома. Понятие об орбиталях.
Слайд 3Строение атома: ядро, электронная оболочка.
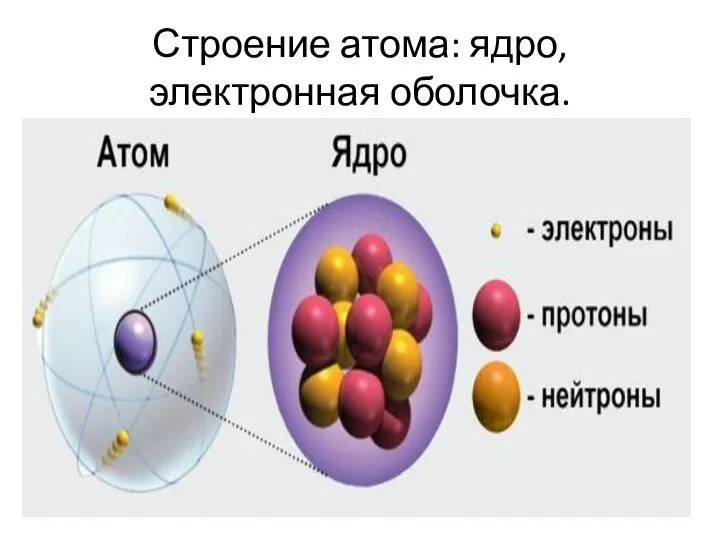
Слайд 4Строение атома: ядро, электронная оболочка.
В результате экспериментов, посвященных изучению строения атома, было

установлено, что атом состоит из положительно заряженного ядра и электронной оболочки.
Ядро образовано протонами и нейтронами.
Слайд 5Строение атома: ядро, электронная оболочка.
Протон — это частица, имеющая положительный заряд

(+).
Нейтрон — это нейтральная частица, заряд ее равен 0.
Слайд 6Строение атома: ядро, электронная оболочка.
Электронная оболочка образована электронами, заряд у которых отрицательный.
Число

электронов равно числу протонов, поэтому заряд атома в целом равен 0 (т. е. атом электронейтральная частица).
Число протонов, а следовательно, заряд ядра и число электронов численно равны порядковому номеру химического элемента.
Слайд 7Строение атома: ядро, электронная оболочка.
Практически вся масса атома сосредоточена в ядре.
Это

связано с тем, что масса электрона настолько меньше массы протона или нейтрона, что ею пренебрегают (не учитывают).
Электроны двигаются вокруг ядра атома, не беспорядочно, а в зависимости от энергии, которой они обладают, образуя так называемый электронный слой.
Слайд 8Строение атома: ядро, электронная оболочка.
На каждом электронном слое может располагаться определенное

число электронов: на первом — не больше двух, на втором — не больше восьми, на третьем — не больше восемнадцати.
Слайд 9Строение атома: ядро, электронная оболочка.
Число электронных слоев определяется по номеру периода,

в котором расположен химический элемент.
Число электронов на последнем (внешнем) слое определяется по номеру группы рассматриваемого элемента.
Слайд 10видео: Электронная конфигурация атома (теор.)
https://101student.ru/himiya/ehlektronnaya-formula-ehlementa.html

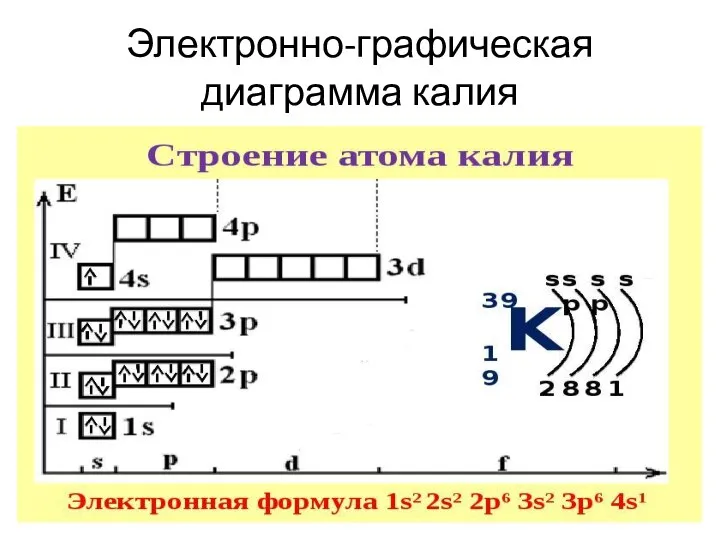
Слайд 11Электронно-графическая диаграмма калия
Слайд 13Порядок заполнения орбиталей
Порядок заполнения орбиталей: 1s → 2s → 2p → 3s
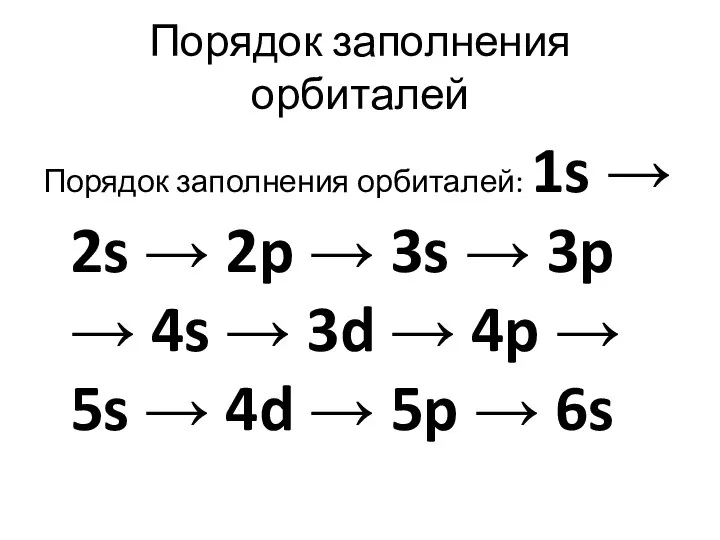
→ 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Слайд 14Практическая работа Электронная конфигурация атомов и ионов
1. Определите, атомы каких из указанных

в ряду элементов в основном состоянии имеют одинаковое число неспаренных электронов
1. Cs 2. C 3. O 4. Cr 5. N
Запишите номера выбранных элементов
Слайд 15Практическая работа Электронная конфигурация атомов и ионов
2. Определите, у атомов каких из

указанных в ряду элементов валентные электроны находятся как на S-, так и на d-подуровнях
1. C 2. Fe 3. Sn 4. Pb 5. Cr
Запишите номера выбранных элементов.
Слайд 16Практическая работа Электронная конфигурация атомов и ионов
3. Определите атомы каких из указанных

в ряду элементов в основном состоянии содержат три неспаренных электрона.
1. Ca 2. P 3. N 4. O 5. Ti
Запишите номера выбранных элементов.
Слайд 17Практическая работа Электронная конфигурация атомов и ионов
4. Определите атомы каких из указанных

в ряду элементов в основном состоянии содержат одинаковое число неспаренных s-электронов.
1. Be 2. H 3. O 4. Cu 5. N
Запишите номера выбранных элементов.
Слайд 18Практическая работа Электронная конфигурация атомов и ионов
5. Определите, атомы каких из указанных

в ряду элементов в основном состоянии имеют электронную формулу внешнего энергетического уровня ns1
1. Li 2. P 3. B 4. Cu 5. N
Запишите номера выбранных элементов.
Слайд 19Практическая работа Электронная конфигурация атомов и ионов
6. Определите, атомы каких из указанных

в ряду элементов имеют семь валентных электронов
1. P 2. Na 3. Cl 4. Mn 5. S
Запишите номера выбранных элементов.
Слайд 20Практическая работа Электронная конфигурация атомов и ионов
7. Определите, атомы каких из указанных

в ряду элементов в основном состоянии имеют сходную конфигурацию внешнего энергетического уровня.
1. P 2. S 3. Ba 4. Ti 5. F
Запишите номера выбранных элементов.
Слайд 21Практическая работа Электронная конфигурация атомов и ионов
8. Определите, катионы каких из указанных

в ряду элементов имеют электронную формулу, совпадающую с электронной формулой атома неона.
1. Al 2. Li 3. Mg 4. C 5. N
Запишите номера выбранных элементов.




















 Номенклатура органических соединений
Номенклатура органических соединений Бөлу процестерінің тиімділігін бағалау әдістерін таңдау және таңдау принциптері
Бөлу процестерінің тиімділігін бағалау әдістерін таңдау және таңдау принциптері Нанотехнологии в быту
Нанотехнологии в быту Фарфор и фаянс
Фарфор и фаянс Удельная теплота сгорания
Удельная теплота сгорания Презентация на тему Лекарства дома
Презентация на тему Лекарства дома  Оксидтер мен негіздердің реакциялары
Оксидтер мен негіздердің реакциялары Основные понятия химической термодинамики
Основные понятия химической термодинамики Силумины. Виды силуминов
Силумины. Виды силуминов Измеритель концентрации асфальтенов в нефти с погружной решёткой Брэгга
Измеритель концентрации асфальтенов в нефти с погружной решёткой Брэгга Определение содержание фосфатов в воде фотометрическим методом
Определение содержание фосфатов в воде фотометрическим методом Магний (Mg)
Магний (Mg) Турнир Деда Мороза. Викторина по химии
Турнир Деда Мороза. Викторина по химии 3bc28ca0711047a6880d20a6763f17db
3bc28ca0711047a6880d20a6763f17db Чистые вещества и смеси
Чистые вещества и смеси Галогены
Галогены Физические свойства элементов 2 (ІІ) - группы
Физические свойства элементов 2 (ІІ) - группы Комплексонометрическое титрование. Часть 2. Лекция 6
Комплексонометрическое титрование. Часть 2. Лекция 6 Элемент протактиний
Элемент протактиний Органическая химия. Теория строения органических соединений
Органическая химия. Теория строения органических соединений Гидролиз солей
Гидролиз солей Сера, соединения серы
Сера, соединения серы Презентация на тему pH жидкостей, необходимых для человека
Презентация на тему pH жидкостей, необходимых для человека  Общая характеристика неметаллов. 9 класс
Общая характеристика неметаллов. 9 класс Химические и физические явления
Химические и физические явления Синтез и магнитные свойства бис(пиразолил)пиридинового комплекса железа II
Синтез и магнитные свойства бис(пиразолил)пиридинового комплекса железа II Основания. 8 класс
Основания. 8 класс Гибридизация атомных орбиталей
Гибридизация атомных орбиталей