Содержание
- 2. Цель урока: обобщить знания учащихся о строении атома, химических элементах, их классификации и формах их существования
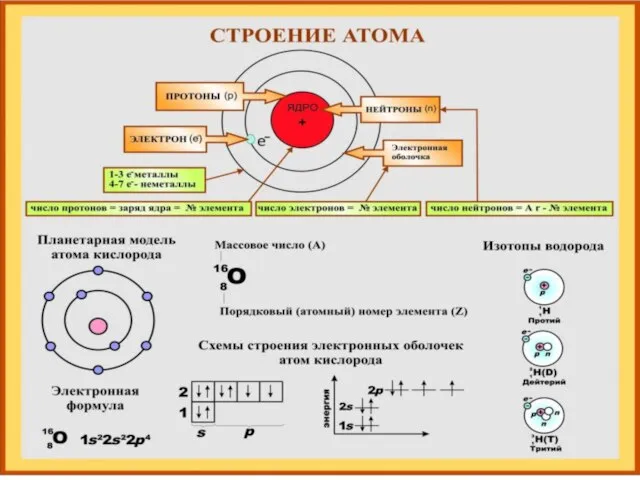
- 3. Вопрос 1. «Периодический закон химических элементов». Современная формулировка закона: «Свойства химических элементов, простых веществ, а также
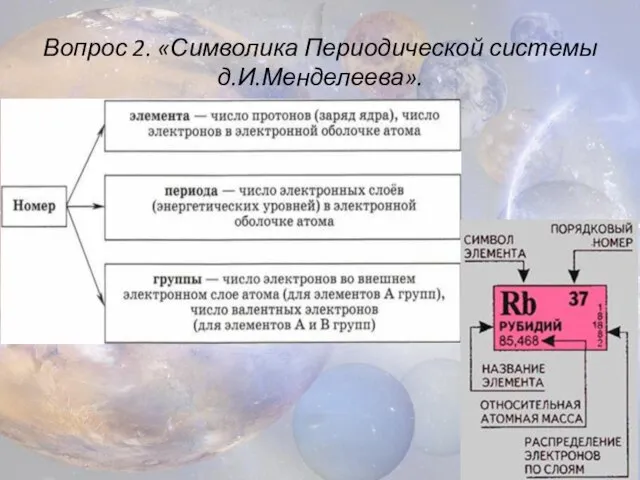
- 5. Вопрос 2. «Символика Периодической системы д.И.Менделеева».
- 6. Вопрос 3. «Закономерности изменения свойств элементов и их соединений» Изменение свойств элементов и образованных ими веществ
- 7. Вопрос 3. «Закономерности изменения свойств элементов и их соединений» Изменение свойств элементов и образованных ими веществ
- 8. Вопрос 3. «Закономерности изменения свойств элементов и их соединений» Изменение свойств элементов и образованных ими веществ
- 9. Вопрос 3. «Закономерности изменения свойств элементов и их соединений» Изменение свойств элементов и образованных ими веществ
- 10. Вопрос 3. «Закономерности изменения свойств элементов и их соединений» Изменение свойств элементов и образованных ими веществ
- 11. Вопрос 3. «Закономерности изменения свойств элементов и их соединений» Изменение свойств элементов и образованных ими веществ
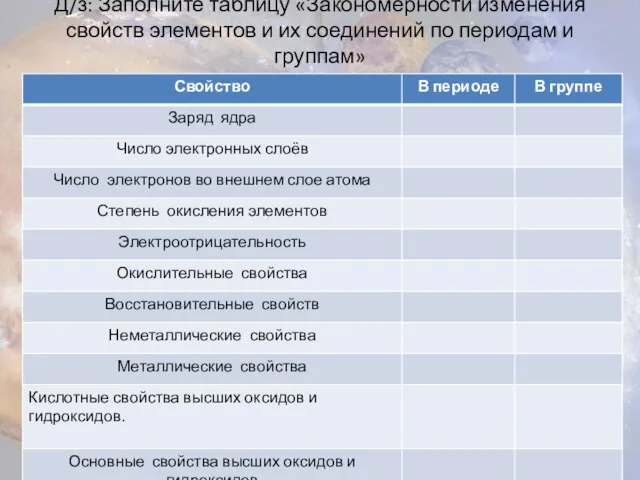
- 12. Д/з: Заполните таблицу «Закономерности изменения свойств элементов и их соединений по периодам и группам»
- 14. Скачать презентацию








 Химическая кинетика
Химическая кинетика Растворение. Растворимость веществ в воде
Растворение. Растворимость веществ в воде Кислотно-основное равновесие
Кислотно-основное равновесие Тест по теме Основные классы неорганических соединений
Тест по теме Основные классы неорганических соединений Физическая химия поверхностных явлений
Физическая химия поверхностных явлений Электролитическая диссоциация кислот
Электролитическая диссоциация кислот 11 класс 15.09
11 класс 15.09 Степень окисления серы
Степень окисления серы Виды работ на уроках химии
Виды работ на уроках химии Презентация на тему Металлическая связь
Презентация на тему Металлическая связь  Действие активированного угля
Действие активированного угля Презентация на тему Твердые вещества
Презентация на тему Твердые вещества  Органическая химия
Органическая химия Природные смолы: мирра, ладан и шеллак
Природные смолы: мирра, ладан и шеллак Положение металлов в периодической системе Д.И. Менделеева и особенности строения их атомов
Положение металлов в периодической системе Д.И. Менделеева и особенности строения их атомов Валентность
Валентность Карбоновые кислоты
Карбоновые кислоты Обобщение знаний по курсу органической химии
Обобщение знаний по курсу органической химии Кислород и сера. Их положение в ПСХЭ. Значение и применение
Кислород и сера. Их положение в ПСХЭ. Значение и применение 20140111_mineraly
20140111_mineraly Кислоты
Кислоты Арены. Ароматические углеводороды
Арены. Ароматические углеводороды Презентация на тему Химические свойства многоатомных спиртов
Презентация на тему Химические свойства многоатомных спиртов  Генетичні зв’язки між неорганічними речовинами
Генетичні зв’язки між неорганічними речовинами Многообразие веществ
Многообразие веществ Калийные удобрения. Лекция 28
Калийные удобрения. Лекция 28 Простагландины. Воздействие фосфолипаз на фосфолипид
Простагландины. Воздействие фосфолипаз на фосфолипид Химия углеводов
Химия углеводов