Содержание
- 2. Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого изменяется рН среды. В процессе
- 4. ОКРАСКА ЛАКМУСОВОЙ БУМАГИ В РАЗЛИЧНЫХ СРЕДАХ
- 5. В зависимости от силы исходной кислоты и исходного основания, образовавших соль, выделяют 4 типа солей. Соли,
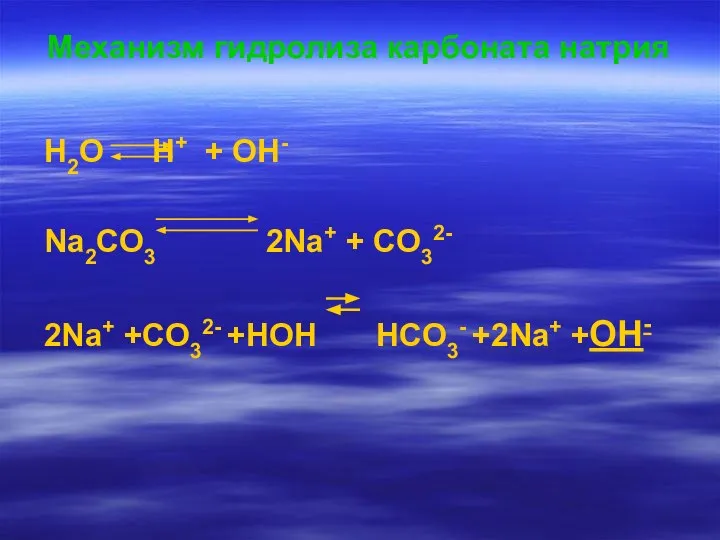
- 6. Механизм гидролиза карбоната натрия H2O H+ + OH- Na2CO3 2Na+ + CO32- 2Na+ +CO32- +HOH HCO3-
- 7. CO32- +HOH HCO3- +OH- Na2CO3 +H2O NaHCO3 +NaOH Одним из продуктов данной обменной реакции является кислая
- 8. Схема гидролиза карбоната натрия Na2CO3 NaOH H2CO3 сильное основание слабая кислота [OH]- > [H]+ (что сильней
- 9. FeCl2 ↔ Fe2+ + 2Cl- Fe2+ + H2O ↔ (FeOH)+ + H+ FeCl2 + H2O ↔
- 10. Механизм гидролиза хлорида алюминия H2O H+ + OH- AlCl3 Al3+ + 3Cl- Al3+ +3Cl- +HOH Al
- 11. Al3+ + HOH AlOH2+ + H+ AlCl3 + H2O AlOHCl2 + HCl Одним из продуктов данной
- 12. Схема гидролиза хлорида алюминия AlCl3 Al(OH)3 HCl слабое основание сильная кислота [OH]- (что сильней того и
- 13. 4. Соли, образованные катионом сильного основания и анионом сильной кислоты не подвергаются гидролизу. К таким солям
- 14. Механизм гидролиза хлорида натрия H2O H+ + OH- NaСl Na+ + Cl- Na+ +Cl- +HOH Cl-
- 15. NaCl + Н2О = Сформулируем вывод: Раствор соли, образованной__________________, имеет________________________реакцию, так как в растворе__________________________________.
- 16. Схема гидролиза карбоната натрия NaCl NaOH HCl сильное основание сильная кислота [OH]- = [H]+ Н е
- 17. Самостоятельно заполните таблицу
- 19. Скачать презентацию




![Схема гидролиза карбоната натрия Na2CO3 NaOH H2CO3 сильное основание слабая кислота [OH]-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1061173/slide-7.jpg)



![Схема гидролиза хлорида алюминия AlCl3 Al(OH)3 HCl слабое основание сильная кислота [OH]-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1061173/slide-11.jpg)



![Схема гидролиза карбоната натрия NaCl NaOH HCl сильное основание сильная кислота [OH]-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1061173/slide-15.jpg)

 Применение центрифугирования
Применение центрифугирования Получение формальдегида методом дегидрирования метанола
Получение формальдегида методом дегидрирования метанола Кислород
Кислород Химический элемент Li
Химический элемент Li Кислоты. Оксиды
Кислоты. Оксиды Амфотерность оксида и гидроксида алюминия
Амфотерность оксида и гидроксида алюминия Презентация на тему Неорганічні речовини живих організмів
Презентация на тему Неорганічні речовини живих організмів  Мышьяк. Висмут. Сурьма
Мышьяк. Висмут. Сурьма Соли как производные кислот и оснований. Цель урока: 1.Дать определение солей. 2. Рассмотреть состав и название солей. 3. Продолжить
Соли как производные кислот и оснований. Цель урока: 1.Дать определение солей. 2. Рассмотреть состав и название солей. 3. Продолжить Аминобензой қышқылы және оның туындыларының синтезі, өндіру әдісі және физика-химиялық қасиеттері
Аминобензой қышқылы және оның туындыларының синтезі, өндіру әдісі және физика-химиялық қасиеттері Термохимия. Термодинамические параметры
Термохимия. Термодинамические параметры Презентация на тему Озоновая дыра
Презентация на тему Озоновая дыра  СТЕПЕНЬ ОКИСЛЕНИЯ
СТЕПЕНЬ ОКИСЛЕНИЯ Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Урок №2
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Урок №2 Основы кристаллографии
Основы кристаллографии ZhK_Prezentatsia_1
ZhK_Prezentatsia_1 Круговорот серы в природе
Круговорот серы в природе Карбоновые кислоты
Карбоновые кислоты Аминокислоты и их применение
Аминокислоты и их применение Обмен углеводов
Обмен углеводов Химия – наука, преобразующая мир для учеников. 7-8 классов
Химия – наука, преобразующая мир для учеников. 7-8 классов Химические уравнения
Химические уравнения Взаимодействие кислот с металлами
Взаимодействие кислот с металлами Обобщение свойств углеводородов
Обобщение свойств углеводородов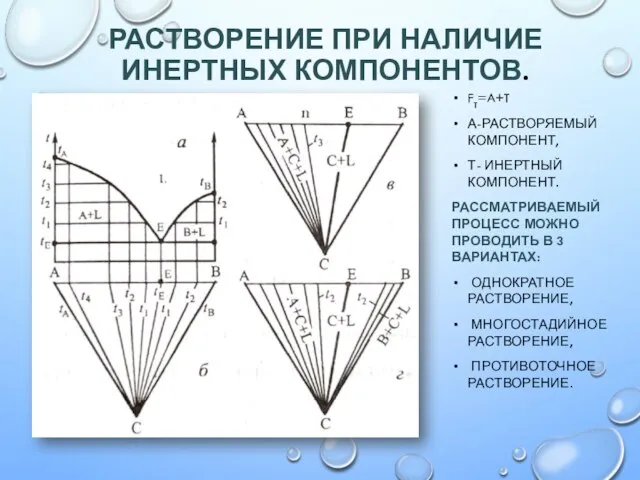 Растворение при наличии инертных компонентов
Растворение при наличии инертных компонентов Химические свойства воды
Химические свойства воды Карбоновые кислоты
Карбоновые кислоты Интерактивный плакат Алканы
Интерактивный плакат Алканы