1 бар
(для газов, жидкостей и твёрдых тел);
Стандартная температура Т= 273 К (tº = 0°С = 32°F) (для газов);
Стандартная молярность СМ = 1 моль/л (для растворов);
Ионное произведение дистиллированной воды
КW = 1,0 × 10−14 моль²/л²
Нормальные условия
Стандартные условия
p = 101325 Па = 101,325 кПа =
= 1 атм = 760 мм рт. ст.
T = 273 K (t°C = 0°C)
p = 100000 Па = 100 кПа = 1 бар
T = 298 K (t°C = 25°C)
Стандартные условия − значения температуры и давления, с которыми соотносятся значения других физических величин, зависящих от давления и температуры
Термодинамика
Стандартное состояние − состояние наиболее стабильной формы вещества (газ, жидкость или твёрдое тело)
Стандартные значения термодинамических величин обозначают нулем в верхнем индексе







 Полимеры в медицине
Полимеры в медицине Презентация на тему Карбоновые кислоты и их производные
Презентация на тему Карбоновые кислоты и их производные  Буферные системы
Буферные системы Электролиз растворов и расплавов
Электролиз растворов и расплавов Алкины
Алкины Антитела. Что такое антитела?
Антитела. Что такое антитела? Лабораторное оборудование. Тесты
Лабораторное оборудование. Тесты Долговечность пластмасс
Долговечность пластмасс Оксиды углерода
Оксиды углерода Презентация на тему Алкины. Ацетилен
Презентация на тему Алкины. Ацетилен  Классификация органических веществ
Классификация органических веществ Строение вещества
Строение вещества Химия — это наука о веществах, их свойствах и превращениях
Химия — это наука о веществах, их свойствах и превращениях Разработка математического описания расчета октанового числа бензинов каталитического риформинга с групповой кинетикой
Разработка математического описания расчета октанового числа бензинов каталитического риформинга с групповой кинетикой Изомерия алкенов
Изомерия алкенов Получение меди
Получение меди Скорость химической реакции
Скорость химической реакции Нефть: история и ее применение
Нефть: история и ее применение Презентация на тему Роль органической химии в жизни человека
Презентация на тему Роль органической химии в жизни человека  Искусство фотографии и химия
Искусство фотографии и химия Арбузный снег. Предположения
Арбузный снег. Предположения Металлы. Своя игра
Металлы. Своя игра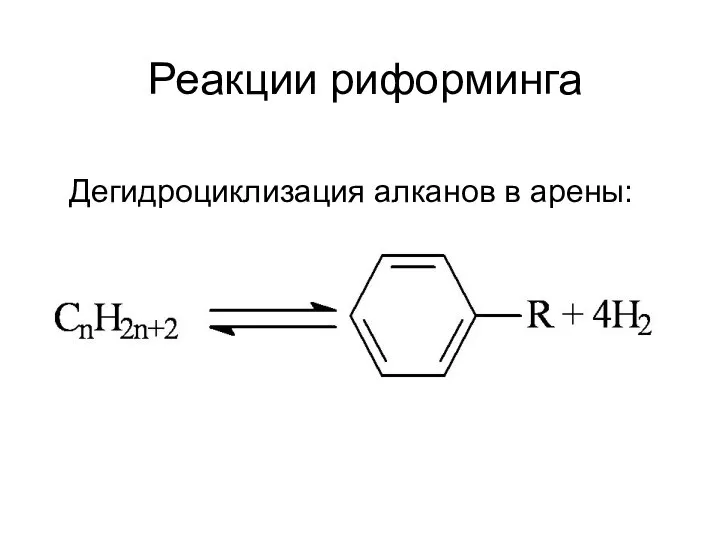 Реакции риформинга
Реакции риформинга Железо и его соединения
Железо и его соединения Лаборатория молекулярной спектроскопии и анализа
Лаборатория молекулярной спектроскопии и анализа Электролиз. Задания
Электролиз. Задания Химические вещества
Химические вещества Презентация на тему Физико-химические свойства алкинов
Презентация на тему Физико-химические свойства алкинов