Содержание
- 2. АЗОТНАЯ КИСЛОТА
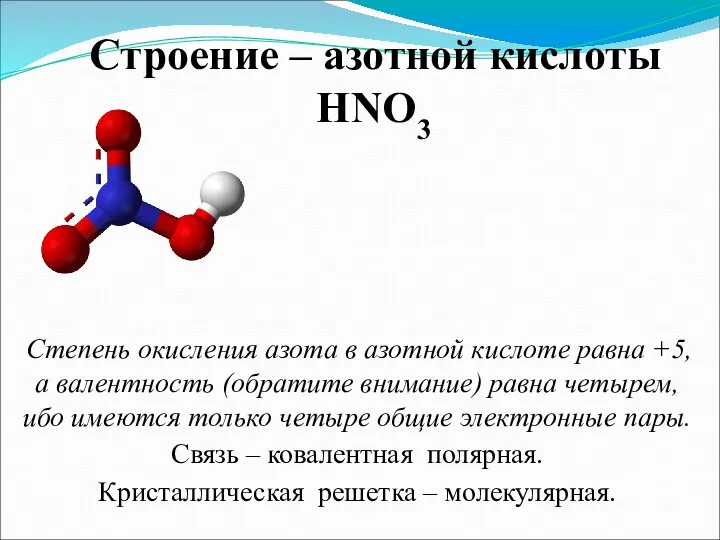
- 3. Строение – азотной кислоты HNO3 Степень окисления азота в азотной кислоте равна +5, а валентность (обратите
- 6. Физические свойства -бесцветная жидкость -на воздухе «дымит», -tкип= +84оС, tпл = -42оС -на свету желтеет из-за
- 8. 1) Изменяет цвет индикаторов (диссоциация): HNO3 = 2) Взаимодействие с основными и амфотерными оксидами: CuO+2HNO3 =
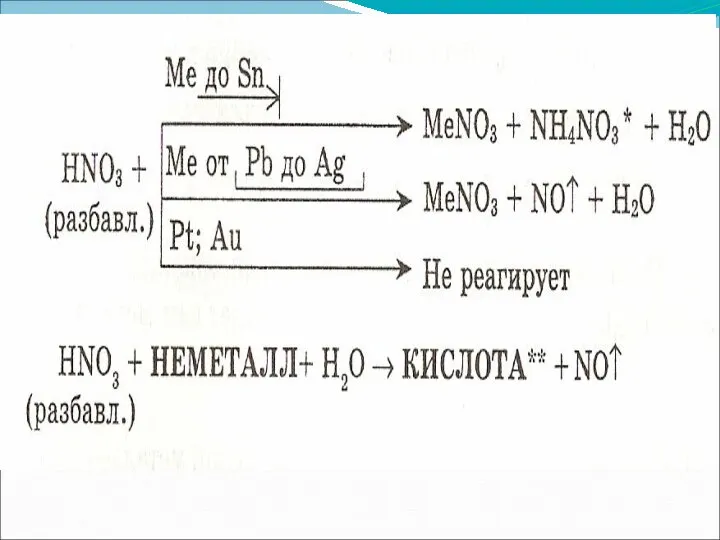
- 9. Специфические свойства – взаимодействие с металлами ЗАПОМНИ! При взаимодействии азотной кислоты любой концентрации с металлами водород
- 12. Специфические свойства Взаимодействие с неметаллами При взаимодействии с неметаллами образуется кислота, в которой у неметалла высшая
- 13. Специфические свойства При нагревании и под действием света разлагается:
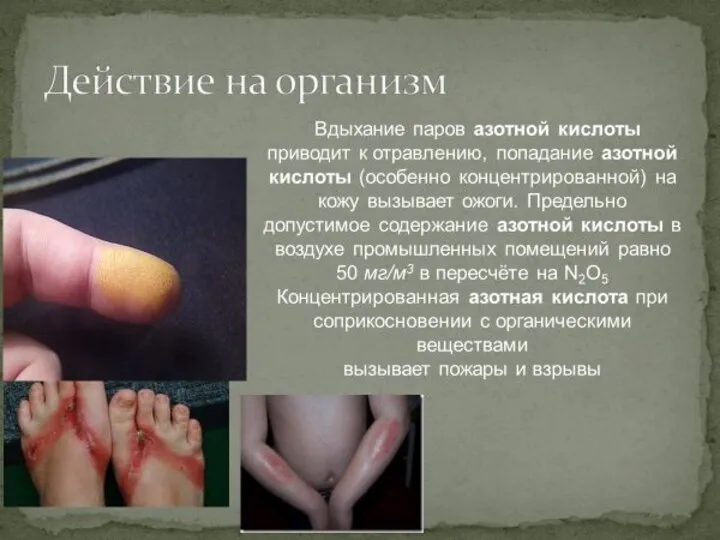
- 14. Действие на органические вещества Белки при взаимодействии с конц.азотной кислотой разрушаются и приобретают жёлтую окраску .
- 16. Смесь концентрированных азотной и соляной кислот (соотношение по объему 1 :3) называется царской водкой; она растворяет
- 18. Упражнения для закрепления 1.Допишите уравнения: HNO3 = NH3 + O2 = NO + O2 = Cu
- 20. Скачать презентацию













 Нефть. Состав, свойства, переработка
Нефть. Состав, свойства, переработка Сравнение свойств неорганических и органических веществ
Сравнение свойств неорганических и органических веществ Жири. Склад жирів, фізичні властивості. Природні й гідрогенізовані жири. Біологічна роль жирів
Жири. Склад жирів, фізичні властивості. Природні й гідрогенізовані жири. Біологічна роль жирів Изучение зависимости скорости химической реакции от различных факторов. Практическая работа № 6
Изучение зависимости скорости химической реакции от различных факторов. Практическая работа № 6 Эмпирические правила
Эмпирические правила Получение галогеноалканов
Получение галогеноалканов Алканы 10-класс
Алканы 10-класс Ковалентная полярная химическая связь
Ковалентная полярная химическая связь Понятие о спиртах
Понятие о спиртах Оптические свойства ювелирных камней. Цвет плеохроизм. Часть 1
Оптические свойства ювелирных камней. Цвет плеохроизм. Часть 1 Классификация неорганических соединений
Классификация неорганических соединений Химические уравнения
Химические уравнения Водород. Вода
Водород. Вода Атомы химических элементов
Атомы химических элементов Серная кислота. Свойства серной кислоты
Серная кислота. Свойства серной кислоты Приложения для отслеживания проб ALS Geochemistry
Приложения для отслеживания проб ALS Geochemistry Предмет органической химии
Предмет органической химии Презентация по Химии "Sulfur"
Презентация по Химии "Sulfur"  Классификация методов аналитической химии
Классификация методов аналитической химии Химическая связь
Химическая связь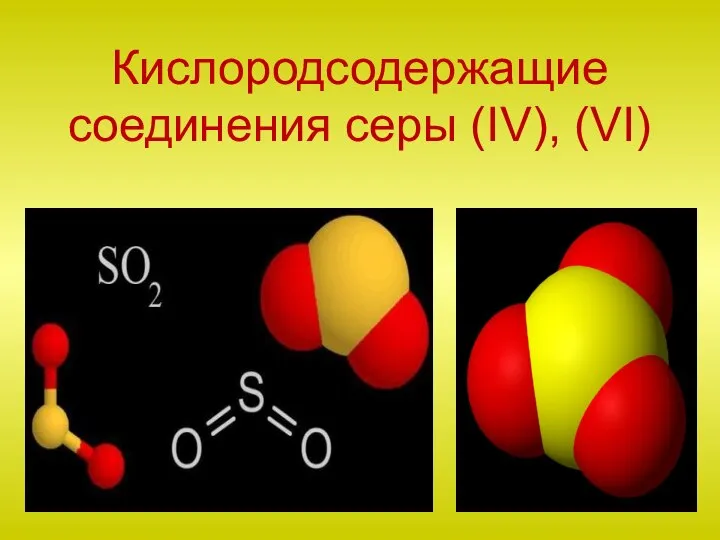 Кислородсодержащие соединения серы (IV), (VI)
Кислородсодержащие соединения серы (IV), (VI) Алкены
Алкены Поликарбонат мономерлері
Поликарбонат мономерлері Презентация на тему Химия в криминалистике
Презентация на тему Химия в криминалистике  Железо и его соединения
Железо и его соединения Кислород и водород
Кислород и водород Электролитическая диссоциация
Электролитическая диссоциация Метод валентных связей
Метод валентных связей