Содержание
- 2. * Учень повинен вміти: наводити приклади сполук із ковалентним та йонним хімічним зв’язком; визначати вид хімічного
- 3. * Вступ Як розвивалось вчення про хімічний зв’язок? Чому і як сполучаються атоми? Чим зумовлене перетворення
- 4. * Розвиток вчення про хімічний зв’язок XVI – XVII століття Механічні теорії Корпускулярні уявлення Збіг форм
- 5. * Динамічні концепції взаємодії речовин XVII століття І. Ньютон Na CI сили притягання Причиною хімічної спорідненості
- 6. * Електрохімічна теорія Початок ХІХ століття Я. Берцелиус Атом – електричний диполь - Na + -
- 7. * Валентність - спорідненість Майже 200 років тому введено поняття валентності Валентність – число хімічних зв’язків,
- 8. * Що являють собою хімічні зв’язки ? 1897 рік Відкриття електрона Дж. Томсон Хімічні зв’язки мають
- 9. * Електронна природа зв’язку Хімічний зв’язок утворюється за рахунок взаємодії всіх електронів і всіх ядер атомів,
- 10. * Умови виникнення хімічного зв’язку Гілберт Ньютон Льюіс 1916 рік ПРАВИЛО ОКТЕТУ Атоми металічних елементів 11Na0
- 12. Скачать презентацию









 Предельные углеводороды насыщенные, парафины, алканы
Предельные углеводороды насыщенные, парафины, алканы Органическая химия- химия соединений углерода
Органическая химия- химия соединений углерода Презентация на тему Кремний и его соединения
Презентация на тему Кремний и его соединения  Ковалентная полярная химическая связь
Ковалентная полярная химическая связь Алюминий и его соединения
Алюминий и его соединения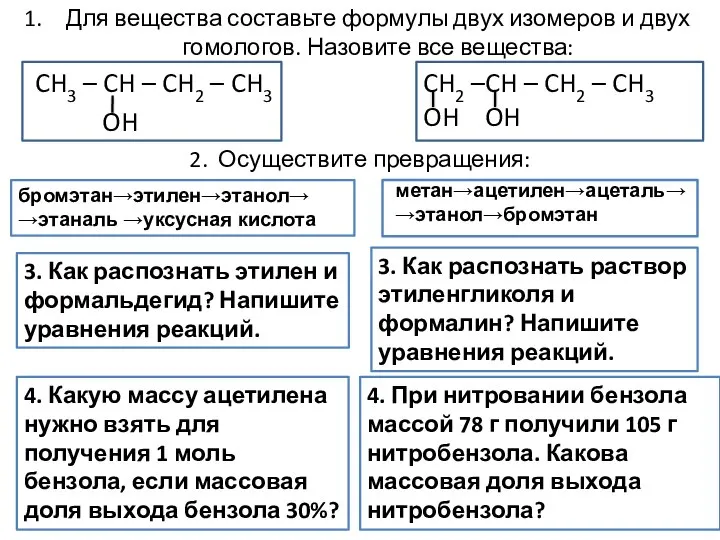 Формулы двух изомеров и двух гомологов
Формулы двух изомеров и двух гомологов Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Органическая химия. Ароматические углеводороды
Органическая химия. Ароматические углеводороды Химия. 8 класс. Подготовка к контрольной работе
Химия. 8 класс. Подготовка к контрольной работе Нанотехнологии в быту
Нанотехнологии в быту Аналитические методы в современных исследованиях химии
Аналитические методы в современных исследованиях химии Биохимия крови
Биохимия крови Элементы принадлежащие к VII группе периодической таблицы - галогены
Элементы принадлежащие к VII группе периодической таблицы - галогены Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Жесткость воды и способы ее устранения
Жесткость воды и способы ее устранения Самостоятельные работы по разделу Химические реакции в рамках рабочей программы по химии для 8 класса
Самостоятельные работы по разделу Химические реакции в рамках рабочей программы по химии для 8 класса Лекция № 1
Лекция № 1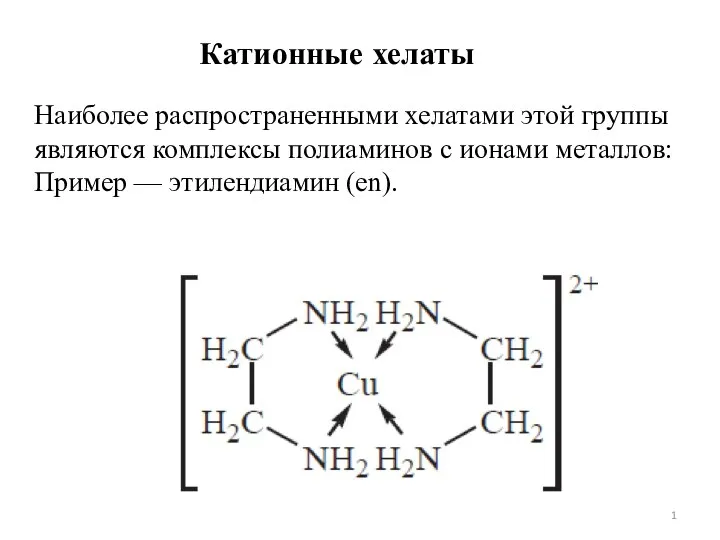 Хелатный эффект. Лекция 7
Хелатный эффект. Лекция 7 Классификация углеводородов
Классификация углеводородов Массовые доли веществ задачи
Массовые доли веществ задачи Классификация аминокислот в зависимости от природы радикалов
Классификация аминокислот в зависимости от природы радикалов Спирты. Общая формула, номенклатура
Спирты. Общая формула, номенклатура Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Урок №2
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Урок №2 Презентация на тему Фосфорная кислота и ее свойства
Презентация на тему Фосфорная кислота и ее свойства  Вещество. Свойства веществ
Вещество. Свойства веществ Минералы
Минералы Относительная атомная масса
Относительная атомная масса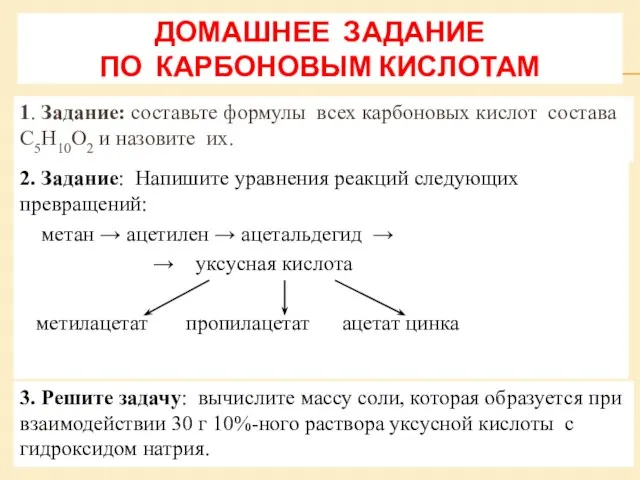 Карбоновые кислоты
Карбоновые кислоты