Содержание
- 2. КИСЛОТЫ-ВОССТАНОВИТЕЛИ К таким кислотам относятся, как правило, бескислородные кислоты, восстановительные свойства которых проявляются за счет аниона
- 3. Среди галогеноводородных кислот самая высокая восстановительная активность у йодоводородной. Её могут окислить даже оксид и соли
- 4. Также восстановительные свойства могут проявлять анионы кислородсодержащих кислот с кислотообразующим элементом в промежуточных степенях окисления –
- 5. К таким кислотам относят, как правило, кислоты с кислотообразующим элементом в высшей степени окисления - H2SO4,
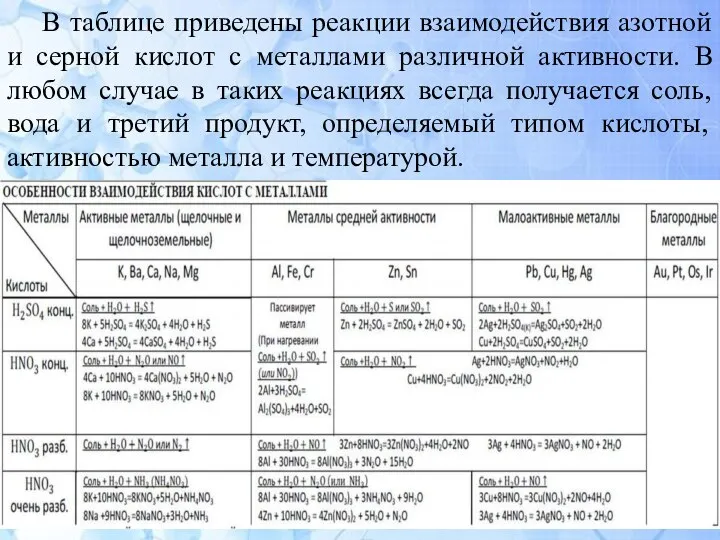
- 6. В таблице приведены реакции взаимодействия азотной и серной кислот с металлами различной активности. В любом случае
- 7. Продуктом взаимодействия кислот-окислителей с неметаллами, как правило, является кислота реагирующего неметалла.
- 8. Кислородсодержащие кислоты галогенов в степени окисления +5 и +7, а также их соли тоже являются хорошими
- 9. Хлорноватая кислота может окислять неметаллы. 6P + 5HClO3 → 3P2O5 + 5HCl Хлораты – сильные окислители.
- 10. Хлорная кислота HClO4 считается самой сильной кислотой (при условии одинаковых концентраций). Хлорная кислота окисляет неметаллы с
- 11. Соли хлорной кислоты – перхлораты - сильные окислители. Например, перхлорат калия при нагревании разлагается. При этом
- 12. В реакциях с металлами проявляет себя следующим образом. Концентрированная (70-72%) на холоду реагирует с активными металлами
- 14. Скачать презентацию










 Проверочные работы по темам: Неметаллы. 9 класс
Проверочные работы по темам: Неметаллы. 9 класс Введение в органическую химию
Введение в органическую химию Методы разделения смесей веществ
Методы разделения смесей веществ Многообразие органических веществ
Многообразие органических веществ Контроль якості імуногематологічних досліджень за допомогою діагностичних моноклональних реагентів та стандартних еритроцитів
Контроль якості імуногематологічних досліджень за допомогою діагностичних моноклональних реагентів та стандартних еритроцитів Основания, их состав и название
Основания, их состав и название Устойчивость коллоидных лиофобных дисперсных систем. Теория ДЛФО. Лекция 14
Устойчивость коллоидных лиофобных дисперсных систем. Теория ДЛФО. Лекция 14 Лекция 4 Строение атома
Лекция 4 Строение атома Презентация на тему Изомерия алкенов
Презентация на тему Изомерия алкенов  Презентация на тему Органическая химия. История развития
Презентация на тему Органическая химия. История развития  Общие знания по курсу неорганической химии
Общие знания по курсу неорганической химии Гибридизация
Гибридизация Алкины. Формулы и названия алкинов
Алкины. Формулы и названия алкинов Кинетика химических реакций и химическое равновесие. Лекция №4
Кинетика химических реакций и химическое равновесие. Лекция №4 Презентация на тему Получение галогенов. Биологическое значение и применение галогенов
Презентация на тему Получение галогенов. Биологическое значение и применение галогенов  Судың диссоциациясы
Судың диссоциациясы Электролитическая диссоциация
Электролитическая диссоциация Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Электролитическая диссоциация
Электролитическая диссоциация Спирты
Спирты Классификация НПВС (по химической структуре активности)
Классификация НПВС (по химической структуре активности) Синтез и реакции пиридазина
Синтез и реакции пиридазина Химия и производство
Химия и производство Адсорбция твёрдыми адсорбентами
Адсорбция твёрдыми адсорбентами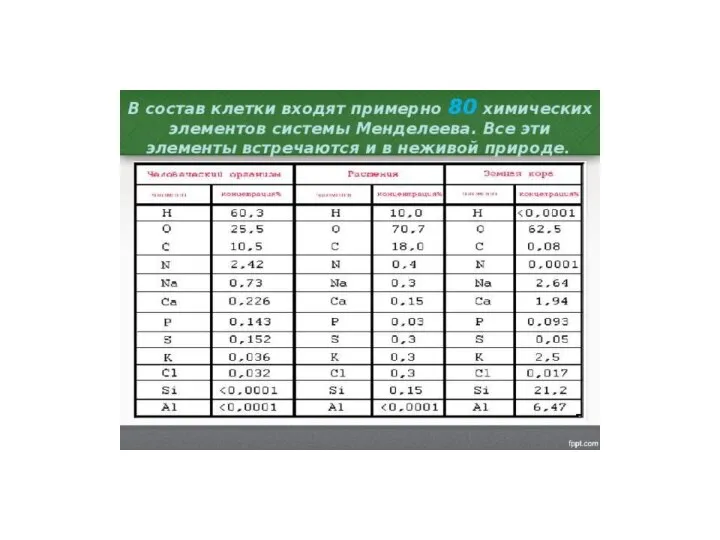 Состав клетки
Состав клетки Реакционная способность химических соединений. Лекция 9
Реакционная способность химических соединений. Лекция 9 Математика в химии
Математика в химии Чистые вещества и смеси, их разделение
Чистые вещества и смеси, их разделение