Содержание
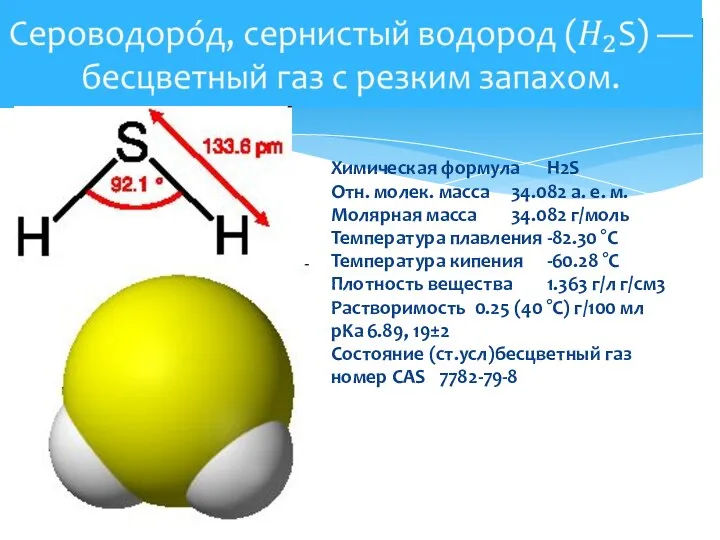
- 2. Химическая формула H2S Отн. молек. масса 34.082 а. е. м. Молярная масса 34.082 г/моль Температура плавления
- 3. Нахождение в природе Встречается в природе в составе нефти, природного газа, вулканического газа и в горячих
- 4. Свойства
- 5. Получение
- 6. Применение Сероводород из-за своей токсичности находит ограниченное применение. В аналитической химии сероводород и сероводородная вода используются
- 8. Скачать презентацию




 Гидролиз солей – частный случай РИО
Гидролиз солей – частный случай РИО Презентация на тему Состав, строение и свойства стекла и хрусталя
Презентация на тему Состав, строение и свойства стекла и хрусталя  Электрохимические процессы
Электрохимические процессы pervonachalnye_svedenia_ob_org_v-kh
pervonachalnye_svedenia_ob_org_v-kh Пятичленные гетероциклы с двумя и более атомами азота
Пятичленные гетероциклы с двумя и более атомами азота Увлекательный мир химии
Увлекательный мир химии Учёные-химики в годы Великой Отечественной войны
Учёные-химики в годы Великой Отечественной войны Углерод
Углерод Основания
Основания Методы получения нафтиридинов (всех изомеров)
Методы получения нафтиридинов (всех изомеров) Составление формул оксидов, оснований, солей
Составление формул оксидов, оснований, солей Химический состав клетки
Химический состав клетки Презентация в 8 классе к уроку по химии на тему__
Презентация в 8 классе к уроку по химии на тему__ Фотохромные биоматериалы. Применение спиропирановых систем в медицине
Фотохромные биоматериалы. Применение спиропирановых систем в медицине Электролитическая диссоциация веществ Реакции ионного обмена и условия их протекания
Электролитическая диссоциация веществ Реакции ионного обмена и условия их протекания Пусть имя Д.И. Менделеева будет нашей путеводной звездой
Пусть имя Д.И. Менделеева будет нашей путеводной звездой Химия в космосе Автор: Гриб Яна ученица 8а класса школа №484. Научный руководитель: Бирюкова Зоя Владимировна.
Химия в космосе Автор: Гриб Яна ученица 8а класса школа №484. Научный руководитель: Бирюкова Зоя Владимировна. Вода как хладагент (R718)
Вода как хладагент (R718) AMFOTERNOST__1
AMFOTERNOST__1 Алкины
Алкины Альдегиды и кетоны (часть 2)
Альдегиды и кетоны (часть 2) Презентация на тему Роль йода в организме
Презентация на тему Роль йода в организме  Перегонка. Вклад алхимиков в органическую химию
Перегонка. Вклад алхимиков в органическую химию Коррозия металлов
Коррозия металлов Электролитическая диссоциация. 9 класс
Электролитическая диссоциация. 9 класс Нефть. Её состав. Термический и каталитический крекинг
Нефть. Её состав. Термический и каталитический крекинг Технологические особенности никеля и никелевых сплавов
Технологические особенности никеля и никелевых сплавов Презентация на тему Бром
Презентация на тему Бром