Содержание
- 2. N 2e 5e – – Азот может принимать степени окисления: –3, +1, +2, +3, +4, +5
- 3. Азот David.Monniaux N N N2
- 4. Азот за счёт прочной тройной связи очень плохо взаимодействует с другими веществами. 6Li + N2 =
- 5. Азот взаимодействует с водородом при высоких температурах, наличии катализатора и высоком давлении с образованием аммиака. N2
- 6. Азот окисляется кислородом также при повышенной температуре, в результате реакции образуется оксид азота (II). Данная реакция
- 7. В природе азот содержится в основном в атмосфере — 78% по объёму или 75,5% по массе.
- 8. Чилийская селитра (NaNO3)
- 9. В производстве азот получают из воздуха, переведённого в жидкое состояние.
- 10. Применение азота Получение аммиака и производства азотной кислоты Применение в медицине в качестве инертной среды при
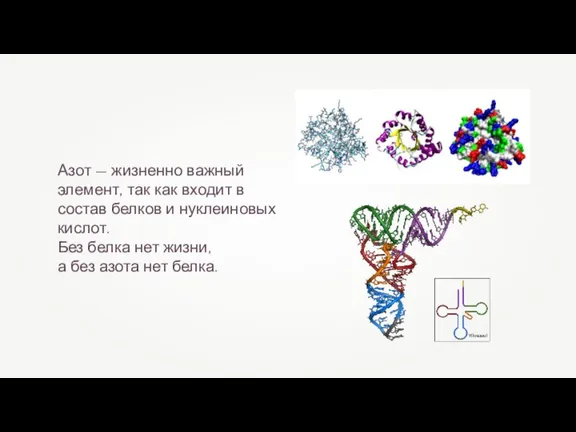
- 11. Азот — жизненно важный элемент, так как входит в состав белков и нуклеиновых кислот. Без белка
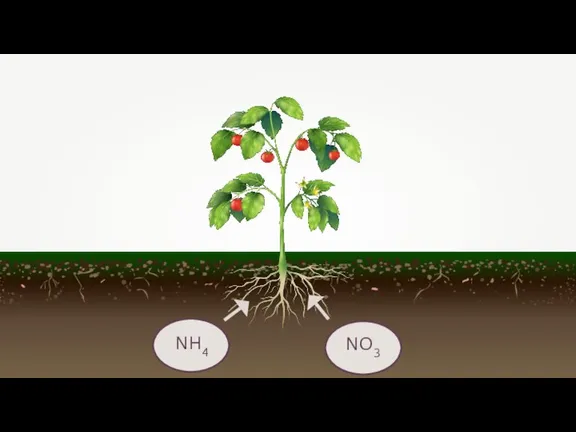
- 14. NH4 NO3
- 15. Организм животного содержит 1–10% азота от общей массы тела, больше всего азота содержится в шерсти, волосах,
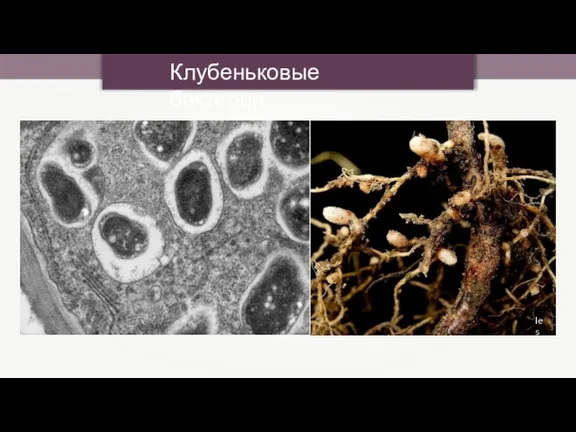
- 16. Клубеньковые бактерии Ies
- 17. Преобразование азота во время грозовых ливней N2 + O2 = 2NO 2NO + O2 = 2NO2
- 18. Д. Резерфорд 1749–1819 гг. К. Шееле 1742–1786гг. Впервые газ, который не поддерживает дыхание и горение, получили
- 19. А. Лавуазье 1778–1825 гг. В 1787 году этот же газ обнаружил в воздухе А. Лавуазье, который
- 21. Скачать презентацию















 Алмашу реакциясе
Алмашу реакциясе Материальный и тепловой балансы абсорбции
Материальный и тепловой балансы абсорбции Понятия и законы в химии. (Лекция 1)
Понятия и законы в химии. (Лекция 1) Основные сведения о строении атома. Состав атомных ядер
Основные сведения о строении атома. Состав атомных ядер Основные понятия химической термодинамики
Основные понятия химической термодинамики Презентация на тему Теория строения органических соединений
Презентация на тему Теория строения органических соединений  Конкурс О, химия – ты муза вдохновения!
Конкурс О, химия – ты муза вдохновения! Алканы, предельные, насыщенные углеводороды (парафины)
Алканы, предельные, насыщенные углеводороды (парафины) Дисперсные системы
Дисперсные системы Важнейшие соединения хлора
Важнейшие соединения хлора Биогенный элемент. Кобальт (Со)
Биогенный элемент. Кобальт (Со) Характеристика металлов по положению в ПСХ
Характеристика металлов по положению в ПСХ Знаки химических элементов
Знаки химических элементов Диеновые углеводороды
Диеновые углеводороды Азотная кислота
Азотная кислота алотропні модифікації неметалів
алотропні модифікації неметалів Органическая химия как наука. Основные положения теории строения химических соединений. Структурная изомерия
Органическая химия как наука. Основные положения теории строения химических соединений. Структурная изомерия Свойства кремниевой кислоты и области применения силикатов
Свойства кремниевой кислоты и области применения силикатов Потенциометрический анализ, титрование
Потенциометрический анализ, титрование Алкены
Алкены Нефть и газ
Нефть и газ Исследование методов синтеза 5-аминосалициловой кислоты
Исследование методов синтеза 5-аминосалициловой кислоты Алкены.Номенклатура
Алкены.Номенклатура Презентация по Химии "Химическая номенклатура и филология"
Презентация по Химии "Химическая номенклатура и филология"  Аллотропия углерода
Аллотропия углерода Алюминий. Положение алюминия в периодической системе и строение его атома
Алюминий. Положение алюминия в периодической системе и строение его атома Бутан как хладагент
Бутан как хладагент Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу
Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу