Содержание
- 2. ЩЕЛОЧНЫЕ МЕТАЛЛЫ
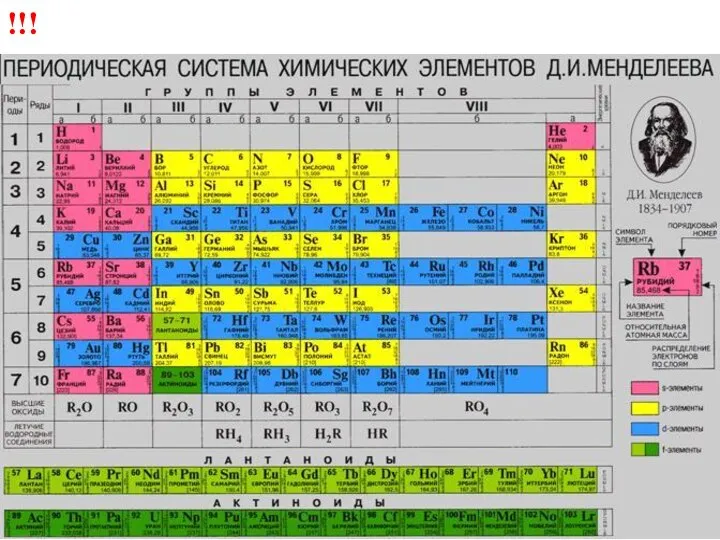
- 3. Щелочные металлы – элементы I A группы !!!
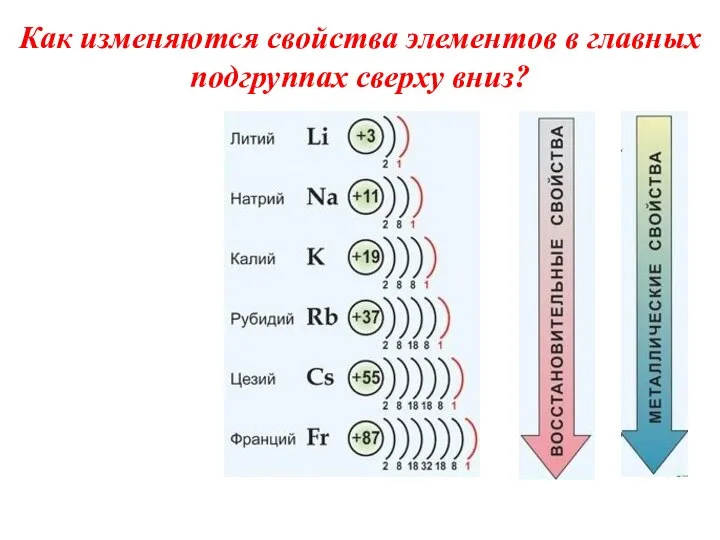
- 4. Как изменяются свойства элементов в главных подгруппах сверху вниз?
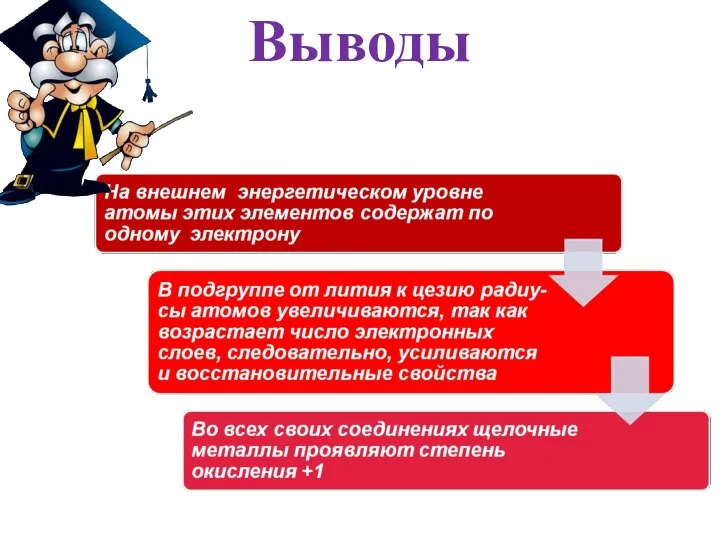
- 5. Выводы
- 6. Физические свойства ЩМ: серебристо-белые (кроме цезия); легкие; легкоплавкие; мягкие (легко режутся ножом)
- 7. I. Взаимодействие с неметаллами 1) ЩМ + O2 ЩМ легко реагируют с кислородом, оксид образует только
- 8. 2) ЩМ + галоген = галогенид Na + Cl2 = Взаимодействие с водородом, серой, фосфором, углеродом,
- 9. II. Взаимодействие ЩМ с водой ЩМ + H2O = гидроксид ЩМ + H2 Na + H2O
- 10. Правила ТБ для работы со щелочными металлами работать в вытяжном шкафу на подносе сухими руками брать
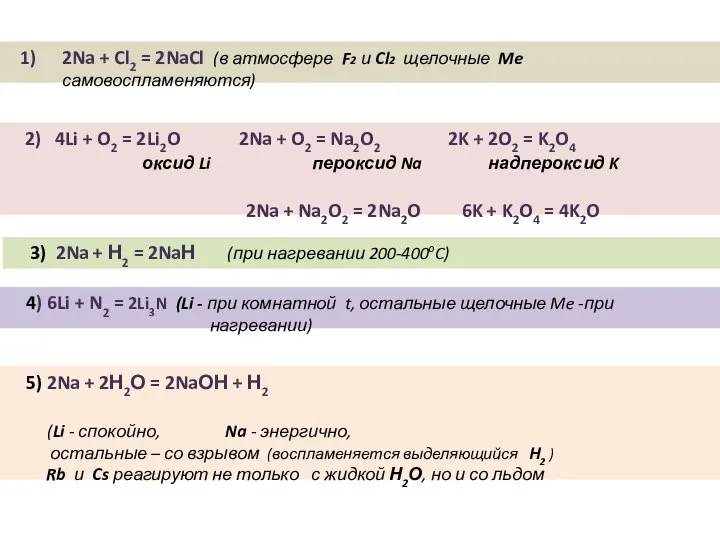
- 11. 2Na + Cl2 = 2NaCl (в атмосфере F2 и Cl2 щелочные Me самовоспламеняются) 2) 4Li +
- 12. Для распознавания соединений щелочных металлов по окраске пламени исследуемое вещество вносится в пламя горелки на кончике
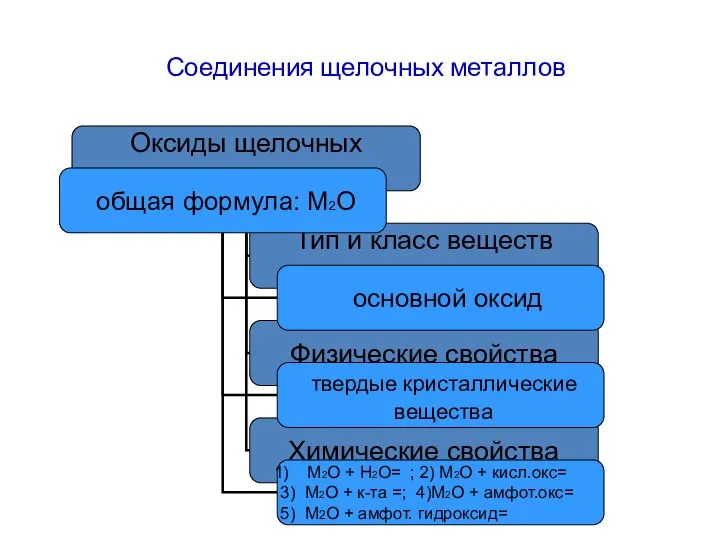
- 13. Соединения щелочных металлов
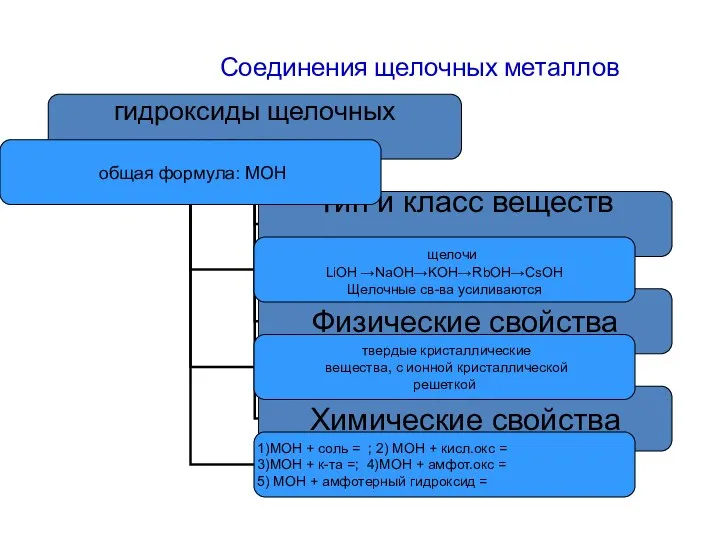
- 14. Соединения щелочных металлов
- 15. Соли щелочных металлов — твердые кристаллические вещества ионного строения. . Nа2СO3 — карбонат натрия, образует кристаллогидрат
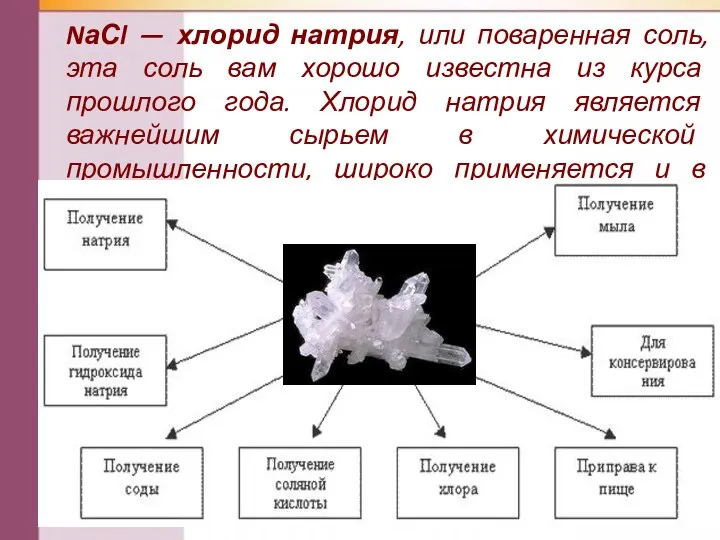
- 16. NаСl — хлорид натрия, или поваренная соль, эта соль вам хорошо известна из курса прошлого года.
- 18. Скачать презентацию








 Эфирные масла
Эфирные масла Химические и физические свойства воды
Химические и физические свойства воды Вода
Вода Ковалентная неполярная связь
Ковалентная неполярная связь Салқындатқыш агенттер
Салқындатқыш агенттер Смазывающие вещества
Смазывающие вещества Комплексонометрическое титрование. 5 лекция. Часть 2
Комплексонометрическое титрование. 5 лекция. Часть 2 Ковалентная полярная связь
Ковалентная полярная связь Веселый химический КВН
Веселый химический КВН Презентация на тему Степень окисления (8 класс)
Презентация на тему Степень окисления (8 класс)  Химическое равновесие
Химическое равновесие Строение атома
Строение атома Материаловедение. Модуль
Материаловедение. Модуль История развития химии
История развития химии Занимательная химия Программу составил
Занимательная химия Программу составил  Решение экспериментальных задач по теме Подгруппы азота и углерода
Решение экспериментальных задач по теме Подгруппы азота и углерода Патриотическое воспитание школьников на уроках
Патриотическое воспитание школьников на уроках Азотные удобрения
Азотные удобрения Обобщение. Неметаллы
Обобщение. Неметаллы Пространственная изомерия органических соединений
Пространственная изомерия органических соединений Ода стеклу и городу-герою Керчи
Ода стеклу и городу-герою Керчи Молекулярно-массовое распределение
Молекулярно-массовое распределение Кислород. Общая характеристика, получение и свойства
Кислород. Общая характеристика, получение и свойства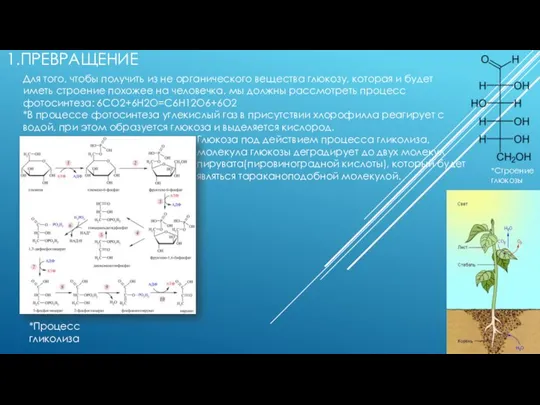 Превращение из не органического вещества в глюкозу
Превращение из не органического вещества в глюкозу Особенности строения электронных оболочек атомов элементов больших периодов
Особенности строения электронных оболочек атомов элементов больших периодов Валентность и ковалентность химической связи
Валентность и ковалентность химической связи Производство метанола
Производство метанола Проточные реакторы непрерывного действия. (Лекция 5)
Проточные реакторы непрерывного действия. (Лекция 5)