Содержание
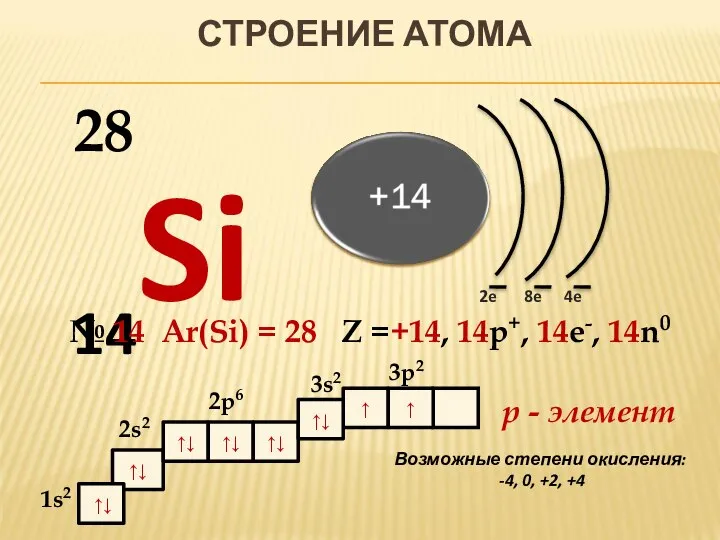
- 2. ↑ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ 1s2 СТРОЕНИЕ АТОМА 14Si 2e 4e 8e № 14 Ar(Si)
- 3. АЛЛОТРОПИЯ КРЕМНИЯ Кристаллический кремний Аморфный кремний темно-серого цвета, обладающий стальным блеском, твердый и хрупкий, с плотностью
- 4. НАХОЖДЕНИЕ В ПРИРОДЕ SiO2 кремнезём (песок) Al2O3∙ 2SiO2∙2H2O каолинит (глина) По распространенности занимает второе место после
- 5. ПРИМЕНЕНИЕ КРЕМНИЯ Кремнистые стали Силиконовый каучук Фотоэлементы Силиконовый герметик
- 6. Силикон – это материал, который очень герметичный и выдерживает при работе большой диапазон температур от -1200С
- 7. 1. В промышленности кремний получают восстановлением диоксида кремния коксом в электрических печах: SiO2+2C=Si+2CO ПОЛУЧЕНИЕ КРЕМНИЯ SiO2
- 8. ХИМИЧЕСКИЕ СВОЙСТВА 1. С галогенами Непосредственно взаимодействует только с фтором, при этом проявляет восстановительные свойства: Si
- 9. 4. С металлами (проявляет окислительные свойства) : 2Ca + Si = Ca2Si 5. С кислотами взаимодействует
- 10. Кремний участвует в различных обменных процессах как катализатор. Есть основания считать, что самостарение в немалой степени
- 11. Кремний - обычный компонент растений, стимулирующий их рост, упрочняет ткани растений и снижает потерю воды. Рекордсменами
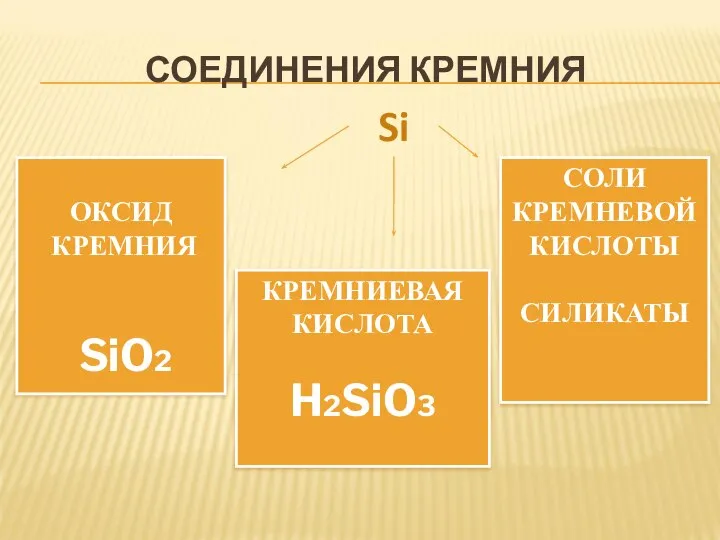
- 12. СОЕДИНЕНИЯ КРЕМНИЯ ОКСИД КРЕМНИЯ SiO2 КРЕМНИЕВАЯ КИСЛОТА H2SiO3 СОЛИ КРЕМНЕВОЙ КИСЛОТЫ СИЛИКАТЫ Si
- 13. ОКСИД КРЕМНИЯ В ПРИРОДЕ Горный хрусталь Халцедон Кварц Аметист Агат Сердолик Песок, ракушки
- 14. СОЕДИНЕНИЯ КРЕМНИЯ ОКСИД КРЕМНИЯ - SIO2 Твердое кристаллическое вещество Атомная кристаллическая решётка Очень твёрдый Нерастворим в
- 15. SIO2 ПРИДАЕТ ПРОЧНОСТЬ СТЕБЛЯМ РАСТЕНИЙ И ЗАЩИТНЫМ ПОКРОВАМ ЖИВОТНЫХ
- 16. ПРИМЕНЕНИЕ SIO2 Силикатный кирпич стекло при получении клеящих и вяжущих материалов
- 17. ОКСИД КРЕМНИЯ(IV), ИЛИ КРЕМНЕЗЁМ ЯВЛЯЕТСЯ КИСЛОТНЫМ ОКСИДОМ. Не растворяется в кислотах (кроме HF) плавиковая кислота SiO2
- 18. КРЕМНИЕВАЯ КИСЛОТА H2SIO3 Na2SiO3 + 2HCl =2NaCl + H2SiO3 ↓ силикат натрия кремневая кислота Получение: Кремниевая
- 19. Двухосновная Кислородсодержащая Слабая Нестабильная Нелетучая Нерастворимая При нагревании разлагается: H2SiO3 → SiO2 + H2O КРЕМНИЕВАЯ КИСЛОТА
- 20. СОЛИ КРЕМНЕВОЙ КИСЛОТЫ Растворимые силикаты натрия и калия называют жидким стеклом
- 21. Аморфный кремний - это малая энергетика. Солнечные батареи из аморфного кремния не боятся ни снега, ни
- 22. Кремниевые солнечные батареи для освещения улиц и домов – это наше настоящее и будущее. Они эффективны
- 24. Скачать презентацию



















 Раздел 1
Раздел 1 Основные сведения о строении атома. Состав атомных ядер
Основные сведения о строении атома. Состав атомных ядер Щелочноземельные металлы
Щелочноземельные металлы Слідство ведуть знавці
Слідство ведуть знавці Диаграмма состояния BaO-Al2O3-SiO2
Диаграмма состояния BaO-Al2O3-SiO2 Lipidy
Lipidy Химия. Подготовка к контрольной работе
Химия. Подготовка к контрольной работе Комплексонометрическое титрование. Часть 2. Лекция 6
Комплексонометрическое титрование. Часть 2. Лекция 6 Алкины и их свойства
Алкины и их свойства Физика полимеров Ч1
Физика полимеров Ч1 Периодический закон Д.И.Менделеева
Периодический закон Д.И.Менделеева Качественная реакция на многоатомные спирты
Качественная реакция на многоатомные спирты Алюминий. Применение
Алюминий. Применение История развития органической химии. 10 класс
История развития органической химии. 10 класс Строение вещества
Строение вещества Фуллерены: аллотропы углерода
Фуллерены: аллотропы углерода Презентация на тему Каучуки
Презентация на тему Каучуки  Коррозия металлов
Коррозия металлов 9 класс Урок №8. Аминокислоты. Белки. Составитель презентации – учитель химии МОУ СОШ г. Холма Насонова Т.А.
9 класс Урок №8. Аминокислоты. Белки. Составитель презентации – учитель химии МОУ СОШ г. Холма Насонова Т.А. Кристаллы
Кристаллы Сахароза. Физические и химические свойства
Сахароза. Физические и химические свойства Химия и сельское хозяйство
Химия и сельское хозяйство Альдегиды и кетоны
Альдегиды и кетоны Соли Na2SO4
Соли Na2SO4 Химические понятия. Вещество. Химические явления. Выдающиеся ученые-химики
Химические понятия. Вещество. Химические явления. Выдающиеся ученые-химики Физико-химия дисперсных систем
Физико-химия дисперсных систем Khim_8
Khim_8 Органическая химия
Органическая химия