Слайд 2Что такое электролиз?
Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных

частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита.
Слайд 3Применение электролиза
Электролиз широко применяется в современной промышленности. В частности, электролиз является одним

из способов промышленного получения алюминия , меди, водорода, диоксида марганца[2], пероксида водорода. Большое количество металлов извлекается из руд и подвергается переработке с помощью электролиза (электроэкстракция, электрорафинирование). Также электролиз является основным процессом, благодаря которому функционирует химический источник тока.
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации).
Применяется для получения многих веществ (металлов, водорода, хлора и др.), при нанесении металлических покрытий (гальваностегия), воспроизведении формы предметов (гальванопластика).
Слайд 5Законы электролиза Фарадея
Зако́ны электро́лиза Фараде́я являются количественными соотношениями, основанными на электрохимических исследованиях, опубликованных Майклом Фарадеем в 1836

году.
Слайд 6Мнемоническое правило
Для запоминания катодных и анодных процессов в электрохимии существует следующее мнемоническое

правило:
У анода анионы окисляются.
На катоде катионы восстанавливаются.
В первой строке все слова начинаются с гласной буквы, во второй — с согласной.
Или проще:
КАТод — КАТионы (ионы у катода)
АНод — АНионы (ионы у анода)
Слайд 7Электролиз в газах
Электролиз в газах, при наличии ионизатора, объясняется тем, что при

прохождении через них постоянного электрического тока наблюдается выделение веществ на электродах. Законы Фарадея в газах не действительны, но существуют несколько закономерностей:
при отсутствии ионизатора электролиз проводиться не будет, даже при высоком напряжении;
электролизу подвергаются только бескислородные кислоты в газообразном состоянии и некоторые газы;
уравнения электролиза, как в электролитах, так и в газах, всегда остаются постоянными.
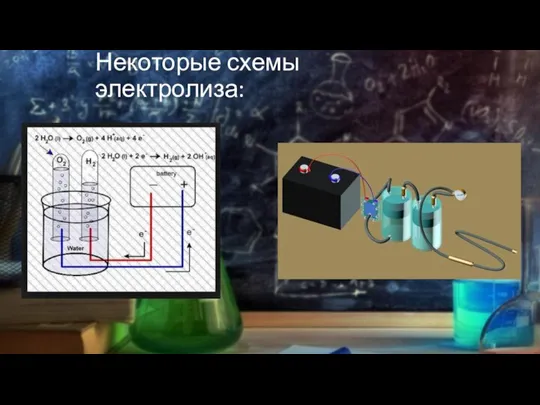
Слайд 8Некоторые схемы электролиза:
Слайд 9Примеры Электрохимических уравнений:









 Застосування рідких кристалів
Застосування рідких кристалів Каталітичні процеси нафтопереробки
Каталітичні процеси нафтопереробки Классификация органических соединений
Классификация органических соединений Топливо и расчеты его горения
Топливо и расчеты его горения Биогаз. Технология производства
Биогаз. Технология производства Простые вещества – неметаллы. Получение и химические свойства неметаллов
Простые вещества – неметаллы. Получение и химические свойства неметаллов Характеристика элемента по положению в таблице Д.И.Менделеева
Характеристика элемента по положению в таблице Д.И.Менделеева Классификация органических соединений. Предельные углеводороды (УВ)
Классификация органических соединений. Предельные углеводороды (УВ) Соединения железа
Соединения железа Моющие и чистящие средства
Моющие и чистящие средства Презентация на тему Экологические риски при добыче и переработке нефти
Презентация на тему Экологические риски при добыче и переработке нефти  Составление формул оксидов, оснований, солей
Составление формул оксидов, оснований, солей Металлы 1 А - группы. Щелочные металлы
Металлы 1 А - группы. Щелочные металлы Методы получения нафтиридинов (всех изомеров)
Методы получения нафтиридинов (всех изомеров) Теория химического строения (ТХС). Предпосылки создания
Теория химического строения (ТХС). Предпосылки создания Электролиз
Электролиз Фенолы и их применение
Фенолы и их применение Коррозионно-активное воздействие на РЭС. Оценка коррозионной стойкости. Лекция №11
Коррозионно-активное воздействие на РЭС. Оценка коррозионной стойкости. Лекция №11 Соли. Применение солей
Соли. Применение солей Соли аммония
Соли аммония Арены
Арены 6. Характеристика элементов на основе положения в периодической системе
6. Характеристика элементов на основе положения в периодической системе Применение каучука
Применение каучука Химическая шкатулка
Химическая шкатулка Искусственные и синтетические ткани
Искусственные и синтетические ткани Текстуры руд
Текстуры руд Научно-исследовательская деятельность учащихся в процессе изучения химии
Научно-исследовательская деятельность учащихся в процессе изучения химии Синтез макромолекул
Синтез макромолекул