Содержание
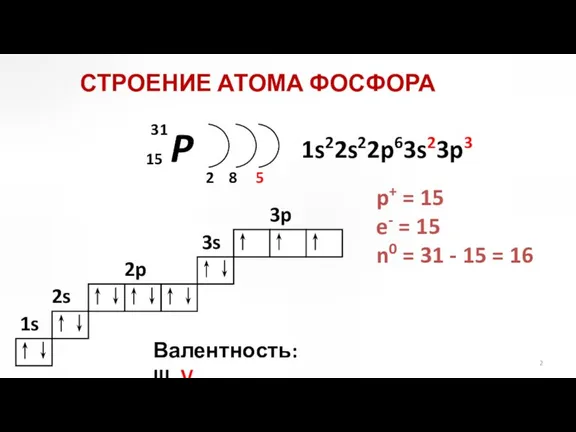
- 2. P 2 5 2p 3s 3p 1s22s22p63s23p3 СТРОЕНИЕ АТОМА ФОСФОРА p+ = 15 e- = 15
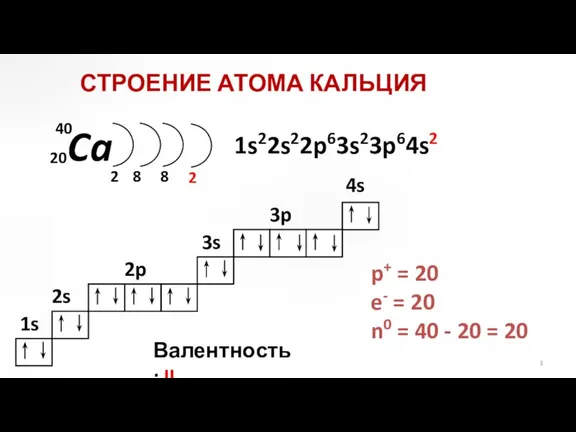
- 3. Ca 2 8 2p 3s 3p 1s22s22p63s23p64s2 СТРОЕНИЕ АТОМА КАЛЬЦИЯ p+ = 20 e- = 20
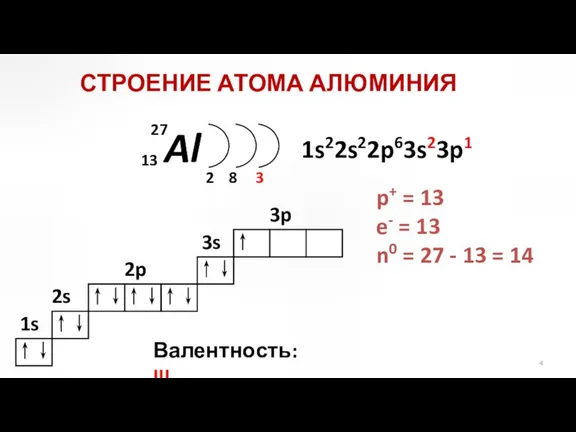
- 4. Al 2 3 2p 3s 3p 1s22s22p63s23p1 СТРОЕНИЕ АТОМА АЛЮМИНИЯ p+ = 13 e- = 13
- 5. СТРОЕНИЕ АТОМА учитель химии: Наумова А.А. Характеристика элементов и их соединений на основе положения элементов в
- 6. Положение элемента в ПС Д.И.Менделеева (номер, период, группа, подгруппа). Строение атома. Электронно-графическая форма записи, семейство элемента.
- 7. 1. Mg – эл. 3 периода, IIA группы, с порядковым № 12 и Ar(Mg) = 24
- 8. Простое вещество Mg - металл, имеет металлическую связь и металлическую кристаллическую решетку. Высший оксид – MgO
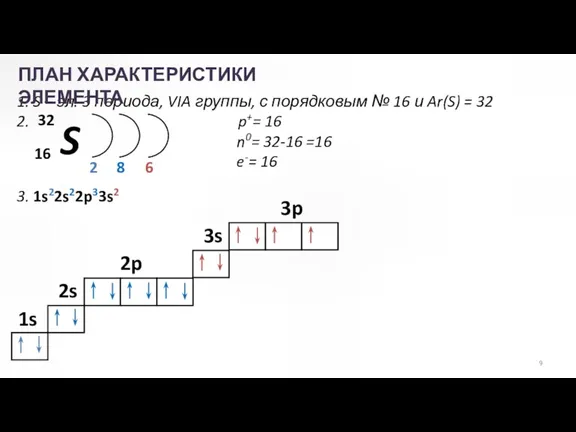
- 9. 1. S – эл. 3 периода, VIA группы, с порядковым № 16 и Ar(S) = 32
- 10. Простое вещество S – неметалл. Высший оксид – SO3 – кислотный. Гидроксид – Н2SO4 – кислота.
- 11. Задания для самостоятельной работы Дайте характеристику элементов: а) фосфора; б) калия.
- 13. Скачать презентацию






 897386 (2)
897386 (2) Кристаллизация и десублимация
Кристаллизация и десублимация Химическое равновесие
Химическое равновесие Разбор заданий на амины
Разбор заданий на амины Цезій
Цезій Количество вещества. Моль
Количество вещества. Моль Аминобензой қышқылы және оның туындыларының синтезі, өндіру әдісі және физика-химиялық қасиеттері
Аминобензой қышқылы және оның туындыларының синтезі, өндіру әдісі және физика-химиялық қасиеттері Презентация на тему Задачи на смеси и сплавы (9 класс)
Презентация на тему Задачи на смеси и сплавы (9 класс) 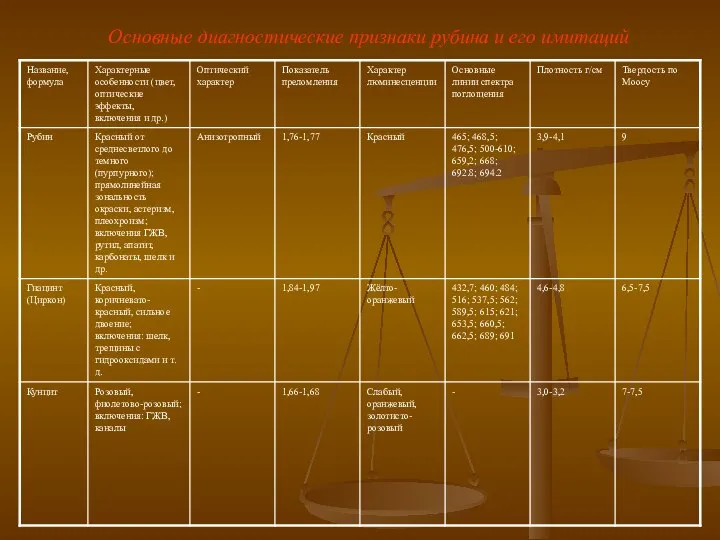 Основные диагностические признаки рубина и его имитаций
Основные диагностические признаки рубина и его имитаций Потенциометрические анализаторы Поверка рН - метра
Потенциометрические анализаторы Поверка рН - метра Катализ в нефтепереработке
Катализ в нефтепереработке proekt_TTU_3_1
proekt_TTU_3_1 Задачи на ионные равновесия
Задачи на ионные равновесия Углеводороды (УВ)
Углеводороды (УВ) Презентация на тему Кремний и его соединения
Презентация на тему Кремний и его соединения  Строение атома. Строение электронных оболочек атомов
Строение атома. Строение электронных оболочек атомов Аммиак
Аммиак Обмен нуклеопротеинов в организме
Обмен нуклеопротеинов в организме Метод высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии
Метод высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии Номенклатура алканов разветвленного строения
Номенклатура алканов разветвленного строения Водородная химическая связь
Водородная химическая связь ТЕМА: БОЛЬШОЙ КРУГОВОРОТ ВЕЩЕСТВ
ТЕМА: БОЛЬШОЙ КРУГОВОРОТ ВЕЩЕСТВ Аллотропия
Аллотропия Кристаллы и аморфные тела
Кристаллы и аморфные тела Поверхностные и массовые силы. Вывод уравнения неразрывности сплошной однокомпонентной среды
Поверхностные и массовые силы. Вывод уравнения неразрывности сплошной однокомпонентной среды Арены. Бензол
Арены. Бензол Презентация на тему Поверхностно-активные вещества
Презентация на тему Поверхностно-активные вещества  Ферментативные методы анализа
Ферментативные методы анализа