Содержание
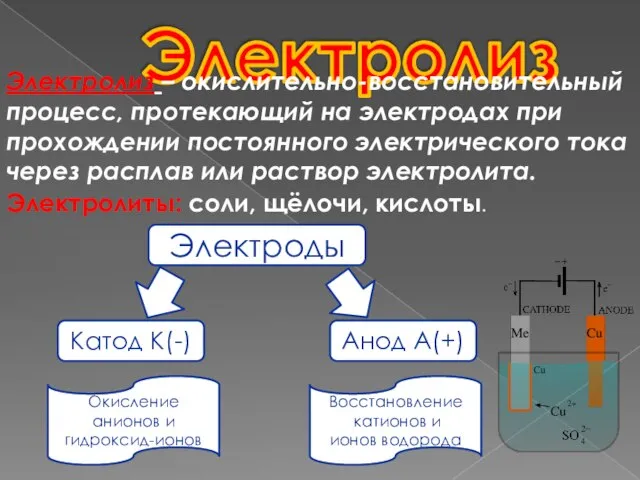
- 2. Электролиз Электролиз – окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплав или
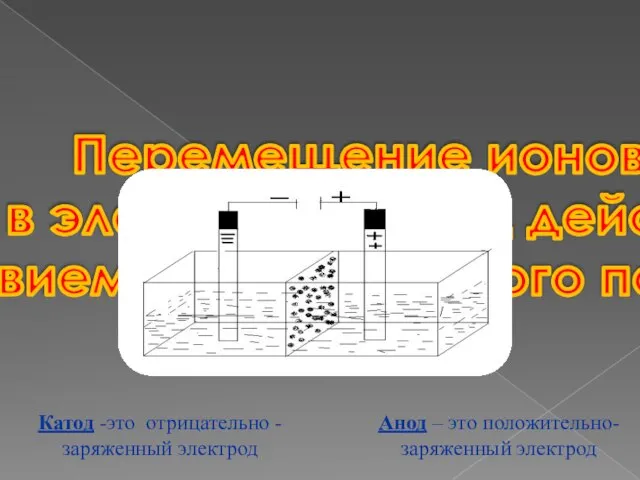
- 3. Перемещение ионов в электролите под дейст- вием электрического поля Анод – это положительно- заряженный электрод Катод
- 4. Процесс на катоде Если в растворе ионы Н+ - они разряжаются до Н2 Металлы правее Н:
- 5. Процесс на аноде если анод растворяется (железо, цинк, медь, серебро и все металлы, которые окисляются в
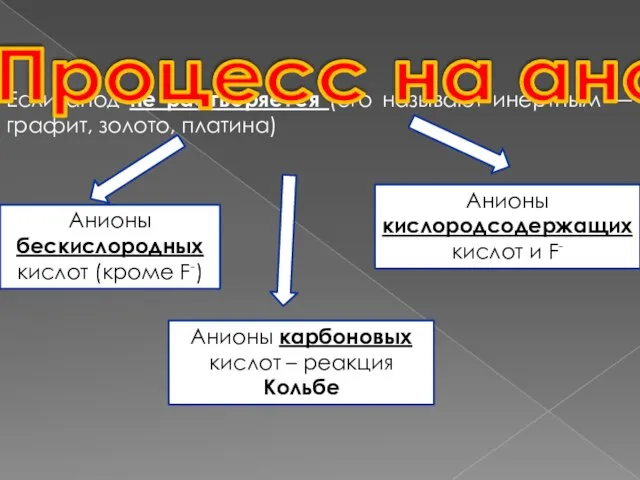
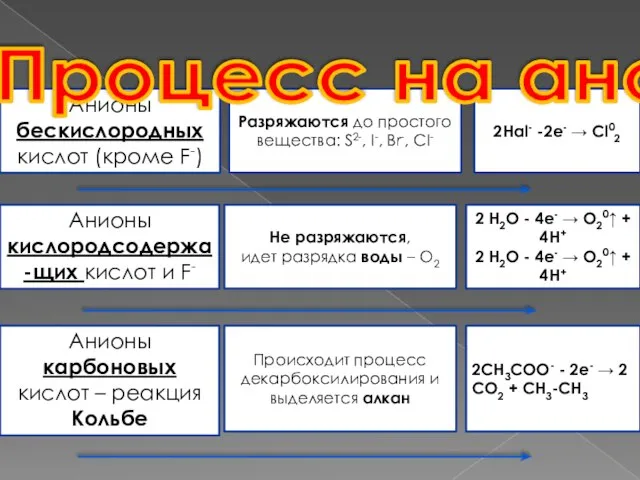
- 6. Если анод не растворяется (его называют инертным — графит, золото, платина) Процесс на аноде Анионы бескислородных
- 7. Анионы бескислородных кислот (кроме F-) Разряжаются до простого вещества: S2-, I-, Br-, СI- 2Hal- -2e- →
- 8. Закон электролиза Законы Фарадея. Масса веществ, выделившегося на электроде при электролизе, пропорциональна количеству электричества, прошедшее через
- 9. Применение электролиза Для получения щёлочных, щёлочноземельных металлов, алюминия, лантаноидов Для получения точных металлических копий, что называется
- 11. Скачать презентацию




 История открытия водорода. Получение и физические свойства водорода
История открытия водорода. Получение и физические свойства водорода Презентация на тему Реакции соединения (8 класс)
Презентация на тему Реакции соединения (8 класс)  Применение коллоидных систем
Применение коллоидных систем ОГЭ химия. Основной государственный экзамен
ОГЭ химия. Основной государственный экзамен Каучук
Каучук Диссоциация. Уравнения диссоциации
Диссоциация. Уравнения диссоциации Сера и ее соединения
Сера и ее соединения Презентация на тему Теория строения органических соединений
Презентация на тему Теория строения органических соединений  Индолы. Cтроение индола
Индолы. Cтроение индола Кислоты в химии
Кислоты в химии Закон сохранения массы и химические уравнения
Закон сохранения массы и химические уравнения Стехиометрические законы химии
Стехиометрические законы химии Общая характеристика неметаллов
Общая характеристика неметаллов Химические связи и взаимное влияние атомов в органических соединениях
Химические связи и взаимное влияние атомов в органических соединениях Спирты
Спирты Ароматические углеводороды. Строение молекулы бензола. Физические свойства
Ароматические углеводороды. Строение молекулы бензола. Физические свойства Полиуретановые полимеры
Полиуретановые полимеры Валентность
Валентность Дизельное топливо
Дизельное топливо Ацетиленовые углеводороды (алкины). Лекция №7
Ацетиленовые углеводороды (алкины). Лекция №7 Презентацию выполнила ученица 10 класса Поликарпова Диана 2010 год
Презентацию выполнила ученица 10 класса Поликарпова Диана 2010 год Электрохимические процессы
Электрохимические процессы Азотсодержащие соединения. (Лекция 13)
Азотсодержащие соединения. (Лекция 13) Вода. Строение молекулы воды. Анализ и синтез воды
Вода. Строение молекулы воды. Анализ и синтез воды Получение серной кислоты
Получение серной кислоты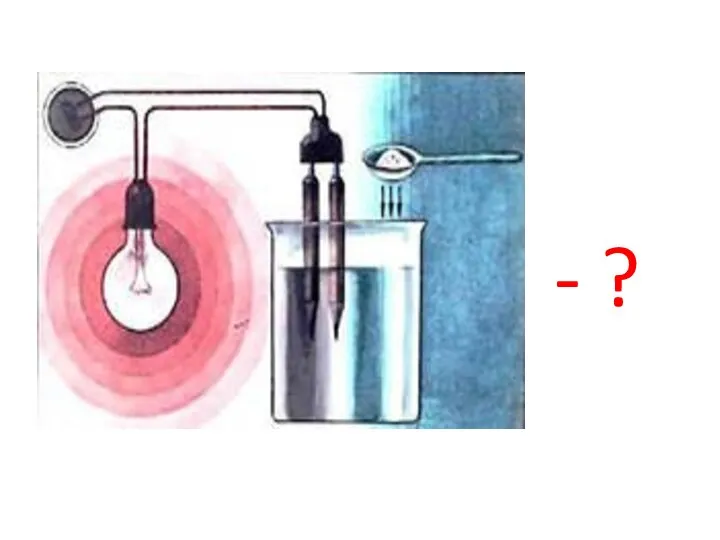 Електролітична дисоціація
Електролітична дисоціація Водород, его общая характеристика, нахождение в природе и его свойства
Водород, его общая характеристика, нахождение в природе и его свойства Соли. Составление формул и номенклатура
Соли. Составление формул и номенклатура