Содержание
- 2. ТЕМА УРОКА: «ПРОСТЫЕ ВЕЩЕСТВА – НЕМЕТАЛЛЫ ПОЛУЧЕНИЕ И ХИМИЧЕСКИЕ СВОЙСТВА НЕМЕТАЛЛОВ» …03.2019г
- 3. 1. Определять взаимосвязь строение со св-ми НеМе 2.Делать выводы по химической активности НеМе 3.Рассматривать химические св-ва
- 4. Тест «Простые вещества - неметаллы» Йод Бром
- 5. 1. Наименьший атомный радиус имеет а) азот b) кислород c) фосфор d) сера 2. Наибольшую электроотрицательность
- 6. 3.Каково агрегатное состояние НеМе? 4. Какова цветовая гамма НеМе? 5. Где находятся НеМе в природе? 6.
- 7. ТЕСТ (ОФОРМЛЕНИЕ ОТВЕТОВ)
- 8. ТЕСТ 1.Окислительные свойства неметаллов по сравнению с металлами: выражены сильнее выражены слабее неметаллы не обладают окислительными
- 9. ТЕСТ 2. Какой из перечисленных элементов входит в состав газа? йод сера бром водород
- 10. ТЕСТ 3. Какой из перечисленных элементов не входит в состав газа? Водород Кислород Бром Азот
- 11. ТЕСТ 4. Какие элементы способны образовывать ионные связи? фтор Хлор Кислород все перечисленные элементы
- 12. ТЕСТ 5. Какой неметалл является самым активным? фтор Кислород Хлор йод
- 13. ТЕСТ 6. Для большинства неметаллов простых веществ характерна: молекулярная кристаллическая решетка атомная кристаллическая решетка металлическая кристаллическая
- 14. ТЕСТ 7. Какие элементы не относятся к органогенным? Углерод Кислород Водород йод
- 15. ТЕСТ 8. Оксид этого неметалла в середине века служил надежным средством дезинфекции от многих болезней SO2
- 16. ТЕСТ 9. Соединения какого элемента используют в пищевой промышленности для продления сроков продуктов? Хлор Азот Водород
- 17. ТЕСТ 10. Зеленоватый газ с резким запахом, ядовитый. Он применялся во время Первой мировой войны в
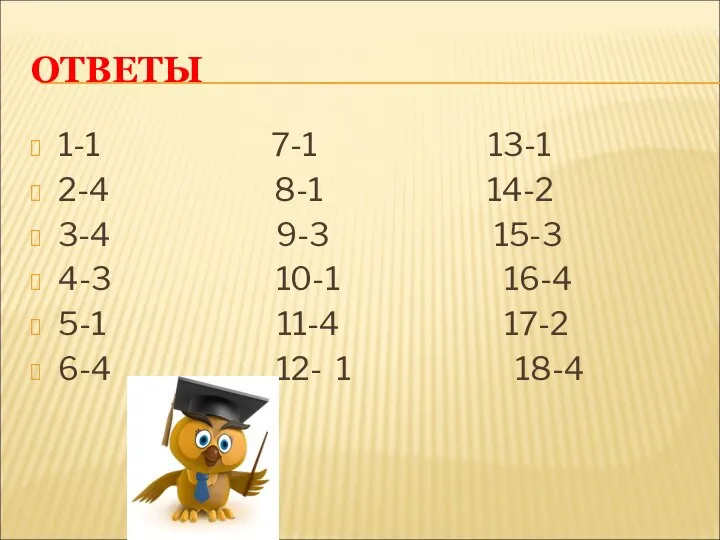
- 18. ОТВЕТЫ 1-1 7-1 13-1 2-4 8-1 14-2 3-4 9-3 15-3 4-3 10-1 16-4 5-1 11-4 17-2
- 19. II.Способы получения неметаллов • Исторически было разработано довольно много способов выделения неметаллов из окружающей среды •
- 20. I.Химические методы получения неметаллов Как правильно выбрать реагенты для химической реакции? Существуют простые правила – по
- 21. ПОЛУЧЕНИЕ КИСЛОРОДА* В промышленности: из воздуха газовой ректификацией: воздух охлаждают и переводят в жидкое состояние, затем
- 22. ПОЛУЧЕНИЕ ВОДОРОДА* В промышленности: 2СН4 + О2 = 2СО + 4Н2 ↑ 2H2O = 2H2 ↑
- 23. ПОЛУЧЕНИЕ ХЛОРА** В промышленности: Действием электрического тока на расплав или водный раствор хлорида натрия: 2NaCl →
- 24. ПОЛУЧЕНИЕ СЕРЫ** В промышленности: Серу, содержащуюся в свободном состоянии (в виде включений) в горных породах, выплавляют
- 25. ПОЛУЧЕНИЕ АЗОТА** В промышленности: (перегонка жидкого воздуха): воздух охлаждают и переводят в жидкое состояние, затем испарением
- 26. ПОЛУЧЕНИЕ УГЛЕРОДА** В промышленности: 1.В настоящее время для промышленного получения чистого углерода используют крекинг природного газа
- 27. Ребята, берегите зрение! Ребята, берегите зрение!
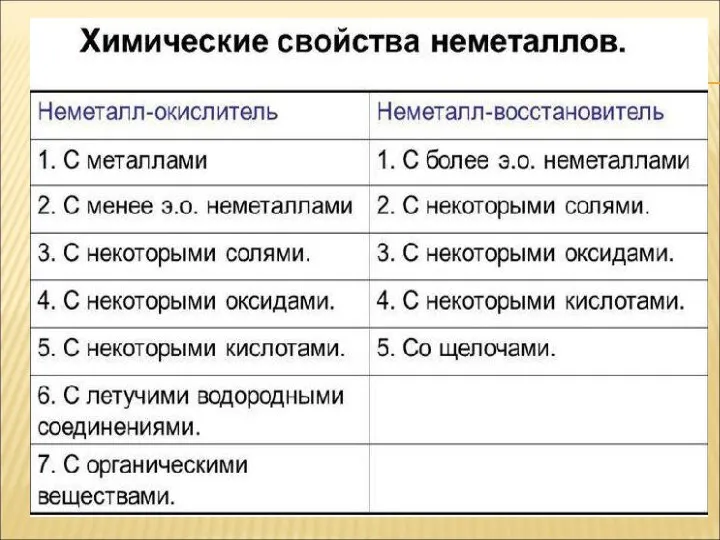
- 28. ХИМИЧЕСКИЕ СВОЙСТВА НЕМЕТАЛЛОВ Описывать химические свойства неметаллов с помощью уравнений реакций 1.Взаимодействие с металлами 2. Взаимодействие
- 30. ЗАПОМНИ Химические элементы-неметаллы могут проявлять как окислительные, так и восстановительные свойства, в зависимости от химического превращения,
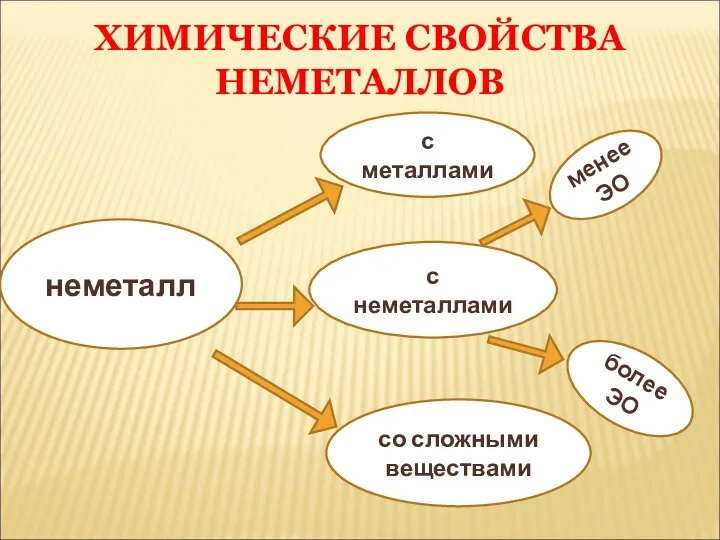
- 31. неметалл с металлами с неметаллами со сложными веществами менее ЭО более ЭО ХИМИЧЕСКИЕ СВОЙСТВА НЕМЕТАЛЛОВ
- 32. I.ВЗАИМОДЕЙСТИЯ С ПРОСТЫМИ В-ВАМИ NB!!! Неметаллы, как окислители!!! 1.Взаимодействие НеМе с металлами.(НеМе ведут себя как окислители
- 33. 2. Взаимодействие НеМе с менее электротрицательными неметаллами: H2 + S = P + Cl2 = 3а.
- 34. Неметаллы, как восстановители. 1.НеМе реагируют с кислородом и фтором S + F2 = S + O2
- 35. HNO3 окисляет неМе до соответствующих кислот 1. У HNO3 (конц) N восстанавливается до NO2 2.У HNO3
- 36. NB!!! Для углерода и водорода как восстановителей характерно взаимодействие с оксидами Ме и неМе ХИМИЧЕСКИЕ СВОЙСТВА
- 37. Пусть эти превращения Дадут вам уравнения. Красный фосфор я сжигаю, К дымку воду приливаю. Проверяю лакмусом,
- 38. ОСУЩЕСТВИТЬ ЦП Бросим мы в костер бревно И получим вещество В кислороде он горит - Получается
- 39. Решите задачи Задача №1. Через раствор, содержащий 10 г едкого натра, пропустили 20 г сероводорода. Какая
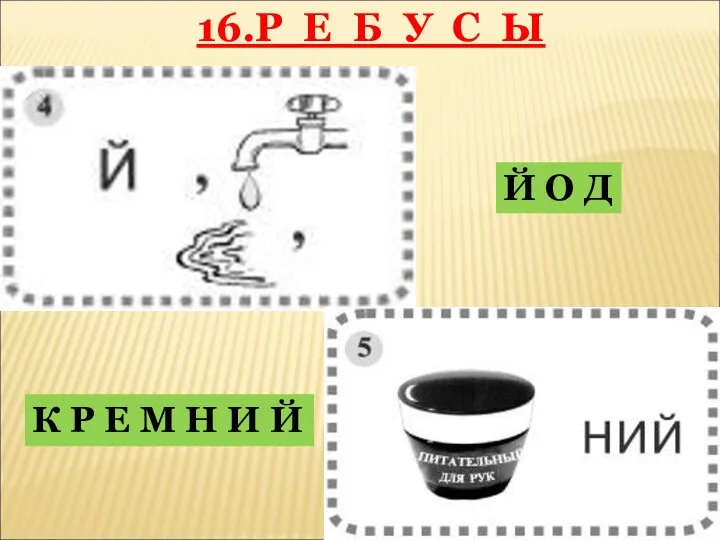
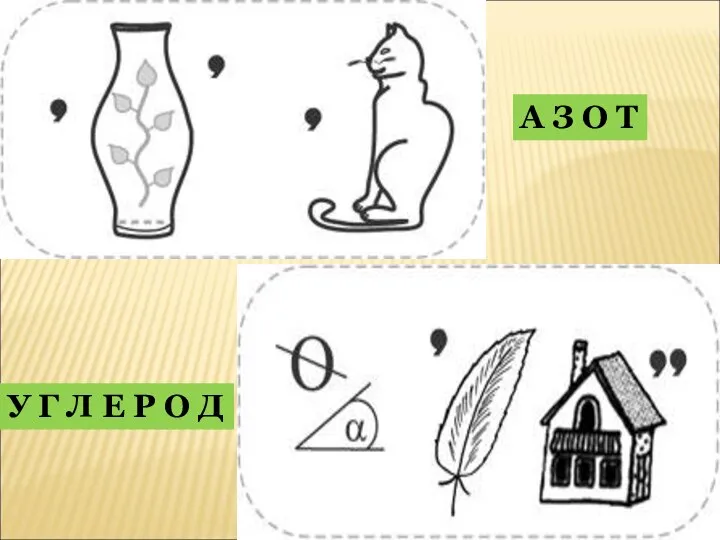
- 40. 16.Р Е Б У С Ы Й О Д К Р Е М Н И Й
- 41. А З О Т У Г Л Е Р О Д
- 42. «Острова» о. Грусти О. Удовольствия о.Тревоги о.Просветления о. Воодушевления о.Неопределенности о. Недоумения о.Радости о.Бермудский треугольник
- 44. Скачать презентацию




































 Натуральные и синтетические каучуки
Натуральные и синтетические каучуки Классификация неорганических соединений
Классификация неорганических соединений Понятие биотехнологии
Понятие биотехнологии Химическая связь
Химическая связь Развитие ассоциативного мышления на уроках химии
Развитие ассоциативного мышления на уроках химии Классификация гетероциклических соединений на основе их химического строения. Противоопухолевые средства
Классификация гетероциклических соединений на основе их химического строения. Противоопухолевые средства Вторичная переработка нефти. Крекинг
Вторичная переработка нефти. Крекинг Развитие познавательной активности творческих способностей и индивидуализация на уроках химии
Развитие познавательной активности творческих способностей и индивидуализация на уроках химии Игровые технологии на уроках химии как средство реализации системно-деятельного подхода в обучении
Игровые технологии на уроках химии как средство реализации системно-деятельного подхода в обучении Органическая химия. Теория строения органических веществ
Органическая химия. Теория строения органических веществ Природные источники углеводородов
Природные источники углеводородов Лекция 6 Нарушения кислотнощелочного равновесия ацидозы, алкалозы
Лекция 6 Нарушения кислотнощелочного равновесия ацидозы, алкалозы Организация самостоятельной работы на уроках химии 8 класса с использованием электронного учебника
Организация самостоятельной работы на уроках химии 8 класса с использованием электронного учебника Изомерия, её виды
Изомерия, её виды Закономерности процессов тепло- и газообмена на пожаре
Закономерности процессов тепло- и газообмена на пожаре Химический анализ воды
Химический анализ воды Строение и химические свойства глюкозы
Строение и химические свойства глюкозы Геохимический анализ поверхностных вод Звенигородской биостанции
Геохимический анализ поверхностных вод Звенигородской биостанции Презентация на тему Сера
Презентация на тему Сера  1.2. Измерения веществ
1.2. Измерения веществ Классификация белков
Классификация белков Взаимодействие плазмы с поверхностью. Проблемы термоядерного реактора
Взаимодействие плазмы с поверхностью. Проблемы термоядерного реактора Основы химической термодинамики. Основные понятия химической термодинамики. Лекция 1
Основы химической термодинамики. Основные понятия химической термодинамики. Лекция 1 Интересные факты о меди
Интересные факты о меди Хим_10_30_Производство_аммиака
Хим_10_30_Производство_аммиака Химия в рисунках или эта удивительная химия
Химия в рисунках или эта удивительная химия Термодинамика. Термодинамические потенциалы
Термодинамика. Термодинамические потенциалы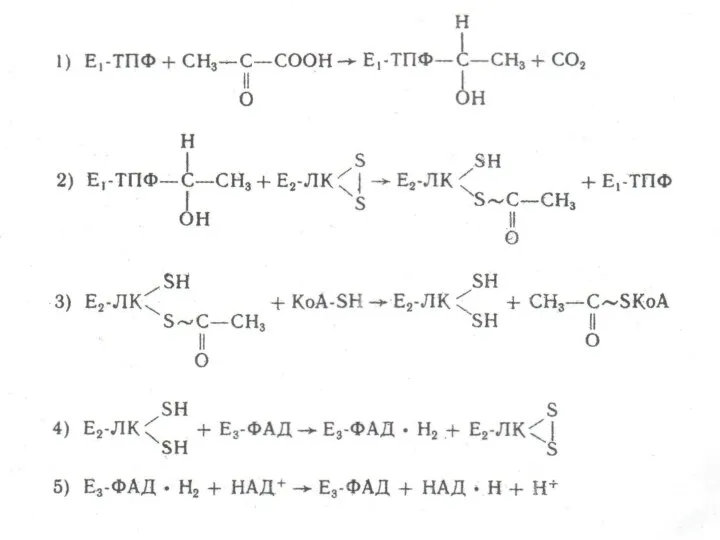 Схема интеграции пентозофосфатного шунта с гликолизом
Схема интеграции пентозофосфатного шунта с гликолизом