Содержание
- 2. Электролиз – это окислительно-восстановительный процесс, протекающий на электродах, при пропускании постоянного электрического тока через раствор или
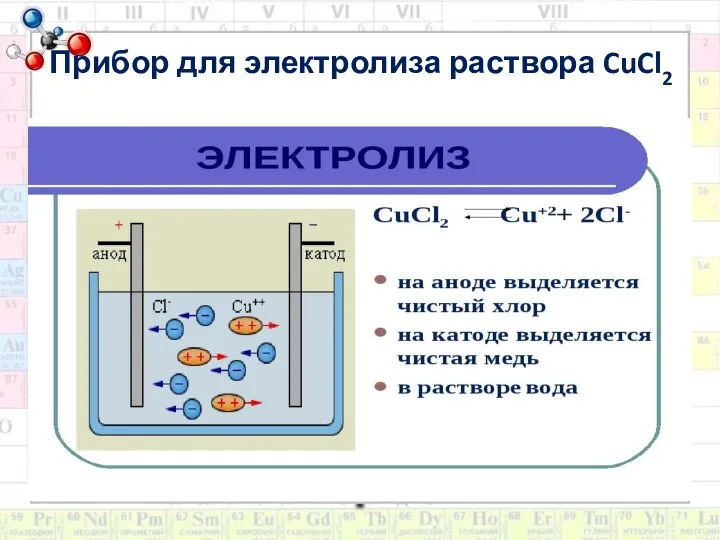
- 6. Прибор для электролиза раствора CuCl2
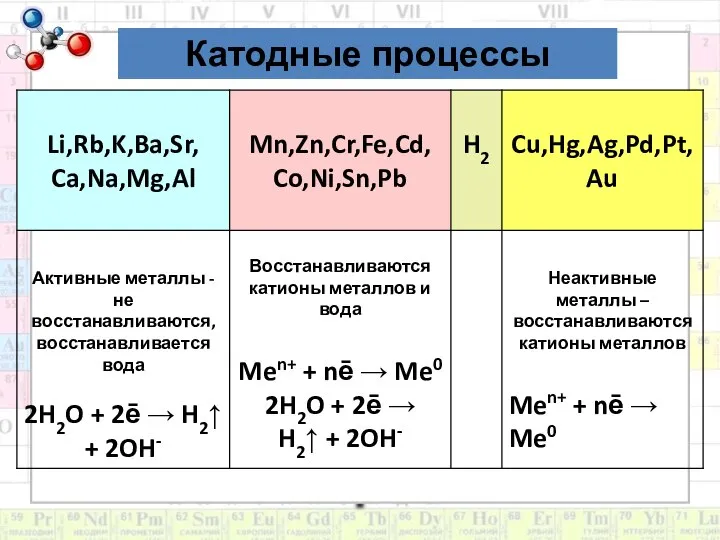
- 7. Катодные процессы: Катионы металлов после Н (от Cu2+ до Au3+) полностью восстанавливаются на катоде. 2. Катионы
- 8. Катодные процессы
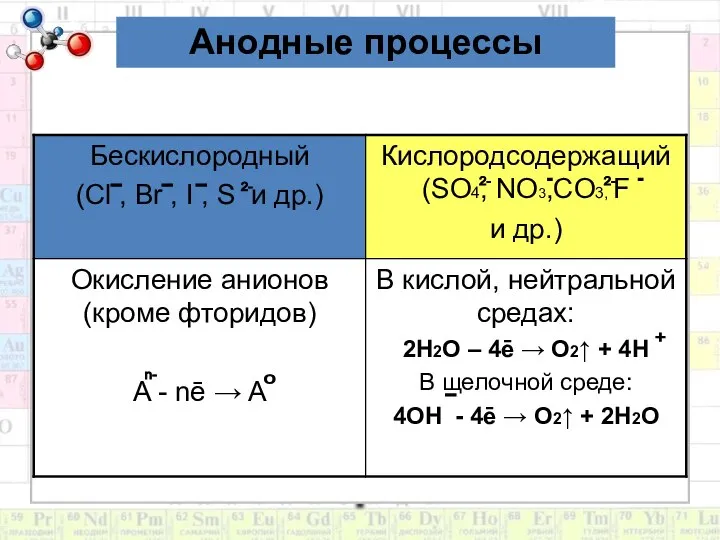
- 9. Анодные процессы В первую очередь на аноде окисляются бескислородные анионы: S²ˉ, Iˉ, Brˉ, Clˉ (кроме Fˉ
- 10. + n- 0 Анодные процессы
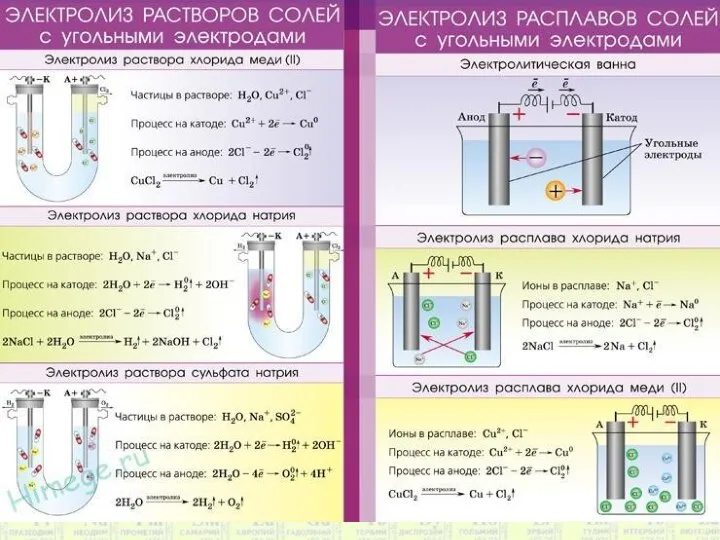
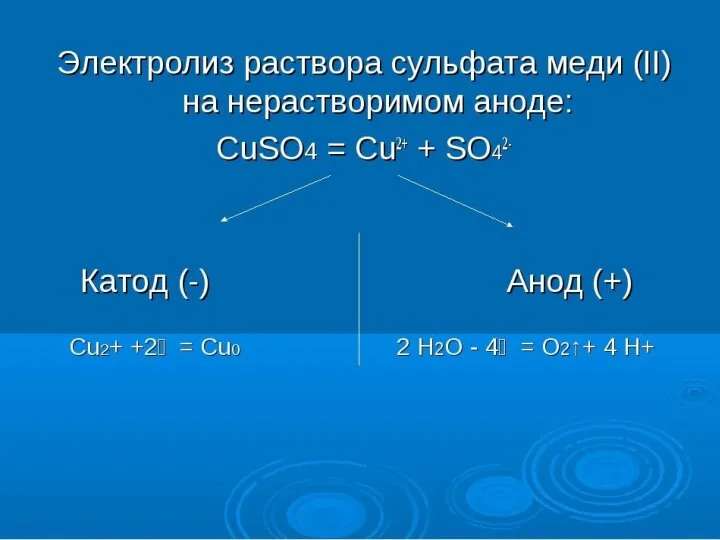
- 11. CuSO4 → Cu2+ + SO4²ˉ -К: Cu2+ + 2ē → Cuº +A: 2H2O – 4ē →
- 12. Na2CО3 → 2Na+ + CО3²ˉ -K: 2H2O + 2ē → H2º +2OH ˉ +А : 2H2O
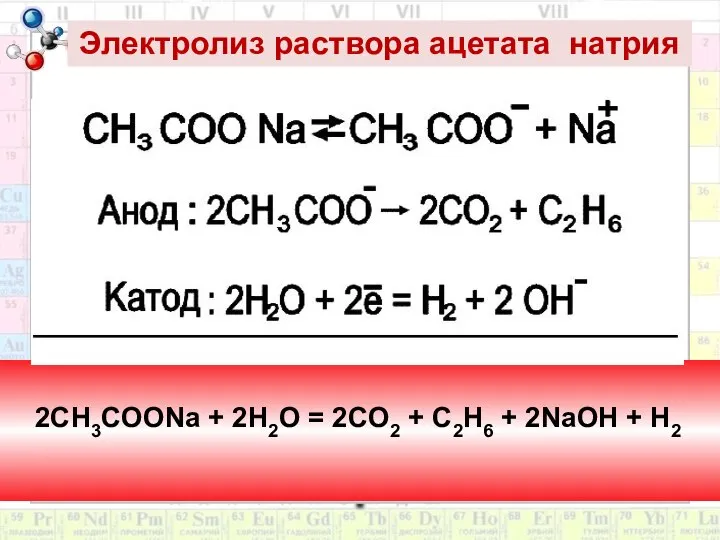
- 13. Электролиз раствора ацетата натрия
- 15. Опыт 1 Электролиз водного раствора йодида калия В U-образную трубку налить раствор йодида калия. В оба
- 17. Опыт 2 Электролиз водного раствора сульфата меди (II) с инертными электродами В U-образную трубку налить раствор
- 20. Опыт 3 Электролиз водного раствора сульфата меди (II) с активным медным анодом Поменять местами электроды (опыт
- 22. Опыт 4 Электролиз водного раствора сульфата натрия В U-образную трубку налить раствор сульфата натрия, опустить в
- 24. Скачать презентацию
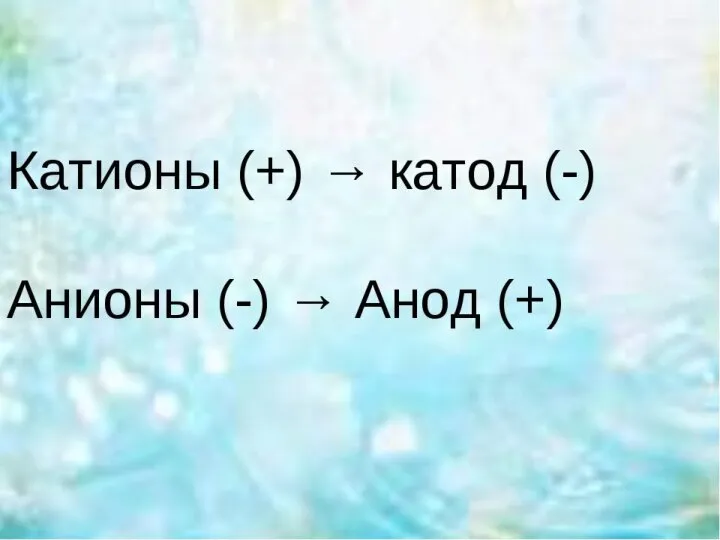














 Химия и производство. Химическая промышленность
Химия и производство. Химическая промышленность Типы кристаллических решёток
Типы кристаллических решёток Предмет химии. Вещества
Предмет химии. Вещества Наука химия. Интеллектуальная игра. 5-8 класс
Наука химия. Интеллектуальная игра. 5-8 класс Презентация по Химии "Электрохимический ряд напряжений металлов. Общие химические свойства металлов"
Презентация по Химии "Электрохимический ряд напряжений металлов. Общие химические свойства металлов"  Экологические характеристики ДВС
Экологические характеристики ДВС Твердые электролиты
Твердые электролиты Ароматические углеводороды
Ароматические углеводороды Производство серной кислоты
Производство серной кислоты Интерактивная интеллектуальная игра. Юный химик
Интерактивная интеллектуальная игра. Юный химик Закон сохранения массы веществ. Типы химических реакций
Закон сохранения массы веществ. Типы химических реакций 1 Класифікація_Завада_лекция 1_укр_2018(1)
1 Класифікація_Завада_лекция 1_укр_2018(1) Выращивание кристаллов
Выращивание кристаллов Карбоновые кислоты
Карбоновые кислоты Применение серы, хлора, углерода
Применение серы, хлора, углерода Спирт и его влияние на организм человека
Спирт и его влияние на организм человека 9_OSNOVY_KOLANALIZA (1)
9_OSNOVY_KOLANALIZA (1) Пусть имя Д.И. Менделеева будет нашей путеводной звездой
Пусть имя Д.И. Менделеева будет нашей путеводной звездой Обозначения групп симметрии по Шенфлису
Обозначения групп симметрии по Шенфлису Дифференциальный термический анализ
Дифференциальный термический анализ Минералы. Самородные элементы
Минералы. Самородные элементы Подготовка к олимпиаде по химии. Некоторые идеи составления и решения нестандартны задач
Подготовка к олимпиаде по химии. Некоторые идеи составления и решения нестандартны задач Хлорорганические соединения
Хлорорганические соединения Степень окисления
Степень окисления Алкадиены
Алкадиены Решение расчетных задач
Решение расчетных задач Тесты для самопроверки
Тесты для самопроверки Коалесцирующие фильтры. Моделирование процесса разделения отходов углеводородов коалесцирующими фильтрами
Коалесцирующие фильтры. Моделирование процесса разделения отходов углеводородов коалесцирующими фильтрами