Слайд 2ЦЕЛИ УРОКА:
ОЗНАКОМИТЬСЯ С О СТРОЕНИЕМ МОЛЕКУЛЫ ВОДЫ
РАССМОТРЕТЬ ФИЗИЧЕСКИЕ СВОЙСТВА ВОДЫ
РАССМОТРЕТЬ

ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ
Слайд 3СТРОЕНИЕ МОЛЕКУЛЫ ВОДЫ:
ФОРМУЛА - Н2О
2 атома водорода и 1 атом
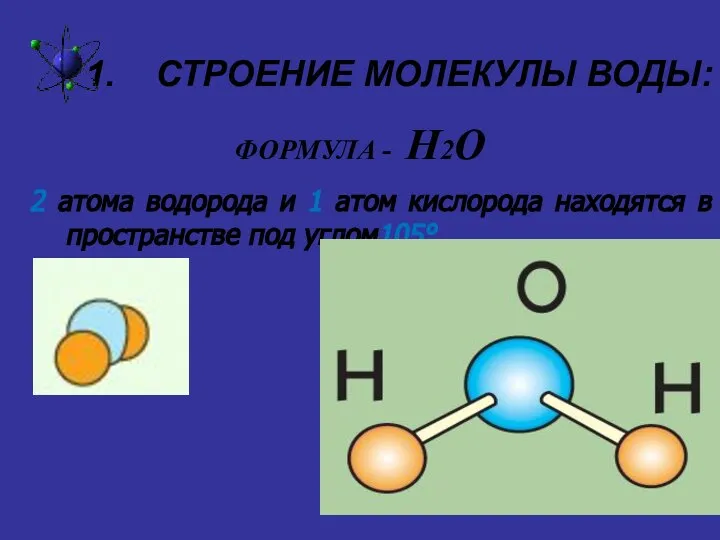
кислорода находятся в пространстве под углом105°
Слайд 52. ФИЗИЧЕСКИЕ СВОЙСТВА ВОДЫ:
ЖИДКОСТЬ - БЕЗ ЦВЕТА, ВКУСА И ЗАПАХА
СУЩЕСТВУЕТ В

ТРЕХ АГРЕГАТНЫХ СОСТОЯНИЯХ
КИПИТ ПРИ 100°С
ЗАМЕРЗАЕТ (ПЛАВИТСЯ) ПРИ 0°С
ПЛОТНОСТЬ 1 Г/МЛ
ОБЛАДАЕТ САМОЙ БОЛЬШОЙ ТЕПЛОЁМКОСТЬЮ
НЕ ПРОВОДИТ ЭЛЕКТРИЧЕСКИЙ ТОК
ПЛОТНОСТЬ ЛЬДА МЕНЬШЕ ПЛОТНОСТИ ВОДЫ
УНИВЕРСАЛЬНЫЙ РАСТВОРИТЕЛЬ
Слайд 73. ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ
1. ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ:
а) очень активные металлы при взаимодействии
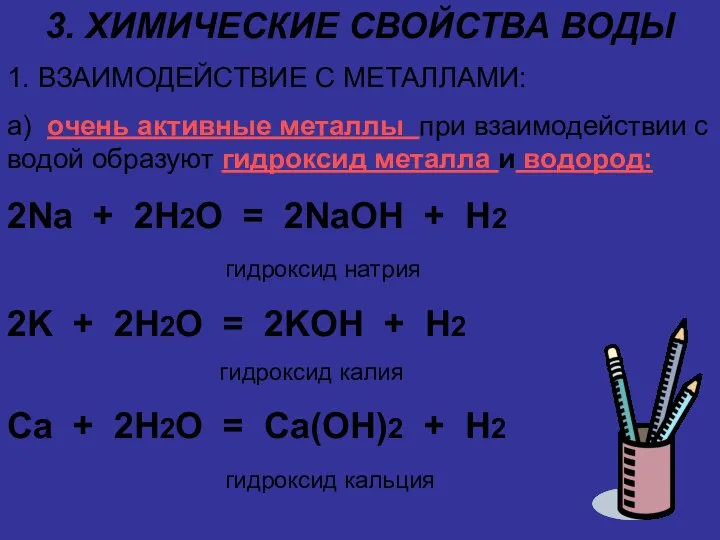
с водой образуют гидроксид металла и водород:
2Na + 2H2O = 2NaOH + H2
гидроксид натрия
2K + 2H2O = 2KOH + H2
гидроксид калия
Ca + 2H2O = Ca(OH)2 + H2
гидроксид кальция
Слайд 8Взаимодействие воды с кальцием

Слайд 9Вопрос:
Почему вода мутнеет от гидроксида кальция и не мутнеет от гидроксидов натрия,

калия и лития?
Слайд 10б) металлы средней активности взаимодействуют с водой при нагревании, образуя оксид металла

и водород:
Zn + H2O = ZnO + H2
оксид цинка
3Fe + 4H2O = Fe3O4 + 4H2
железная окалина
в) малоактивные металлы с водой
не реагируют:
Cu + H2O =
Слайд 112. ВЗАИМОДЕЙСТВИЕ ВОДЫ С ОКСИДАМИ:
а) оксиды активных металлов при взаимодействии с водой

образуют гидроксиды:
CaO + H2O = Ca(OH)2
гидроксид кальция
K2O + H2O = 2 KOH
гидроксид калия
Слайд 12Взаимодействие оксида серы (IV) с водой

Слайд 13б) оксиды неметаллов при взаимодействии с водой образуют кислоты:
SO2 + H2O

= H2SO3
cернистая кислота
SO3 + H2O = H2SO4
серная кислота
Слайд 14P2O5 + 3H2O = 2H3PO4
ортофосфорная кислота

Слайд 153. Разложение воды под действием электрического тока (электролиз):
2H2O = 2H2 ↑ +

O2 ↑
Слайд 17Рефлексия:
Я узнал, что…
Я научился…
Я понял…


















 Характеристика кислорода и серы
Характеристика кислорода и серы Химические свойства оксидов
Химические свойства оксидов Количество вещества
Количество вещества Растворы
Растворы Масляная кислота
Масляная кислота Презентация на тему Серная кислота (9 класс)
Презентация на тему Серная кислота (9 класс)  Презентация на тему Увлекательные факты из жизни Менделеева
Презентация на тему Увлекательные факты из жизни Менделеева  Причины протекания химических реакций
Причины протекания химических реакций Хімія у вирішенні промислової проблеми
Хімія у вирішенні промислової проблеми Амины. Номенклатура
Амины. Номенклатура Уксусная кислота
Уксусная кислота Углерод
Углерод Ароматические углеводороды на примере бензола
Ароматические углеводороды на примере бензола Спирты и фенолы
Спирты и фенолы Равновесия в растворах электролитов. Окислительно-восстановительные реакции
Равновесия в растворах электролитов. Окислительно-восстановительные реакции Фосфаттардағы байланыс теориясы
Фосфаттардағы байланыс теориясы Пластмассы
Пластмассы lektsia_5
lektsia_5 10-2 основные положения теории Бутлерова
10-2 основные положения теории Бутлерова Cкорость химических реакций
Cкорость химических реакций Мицеллобразование (2)
Мицеллобразование (2) Растворы. 11 класс
Растворы. 11 класс Основные полимеры, используемые для производства электроизоляционных материалов и пропиточных составов
Основные полимеры, используемые для производства электроизоляционных материалов и пропиточных составов Классификация химических реакций. Окислительно-восстановительные реакции
Классификация химических реакций. Окислительно-восстановительные реакции Сложные реакции
Сложные реакции Магний - активный, но под защитой
Магний - активный, но под защитой Основания. 8 класс
Основания. 8 класс Адсорбция. Адсорбент
Адсорбция. Адсорбент