Содержание
- 2. ОСНОВНІ ВИЗНАЧЕННЯ Система – це сукупність взаємодіючих речовин, які уявно або фактично відокремлені від навколишнього середовища.
- 3. ЗА ХАРАКТЕРОМ ВЗАЄМОДІЇ З НАВКОЛИШНІМ СЕРЕДОВИЩЕМ Відкрита термодинамічна система - це система, яка обмінюється з навколишнім
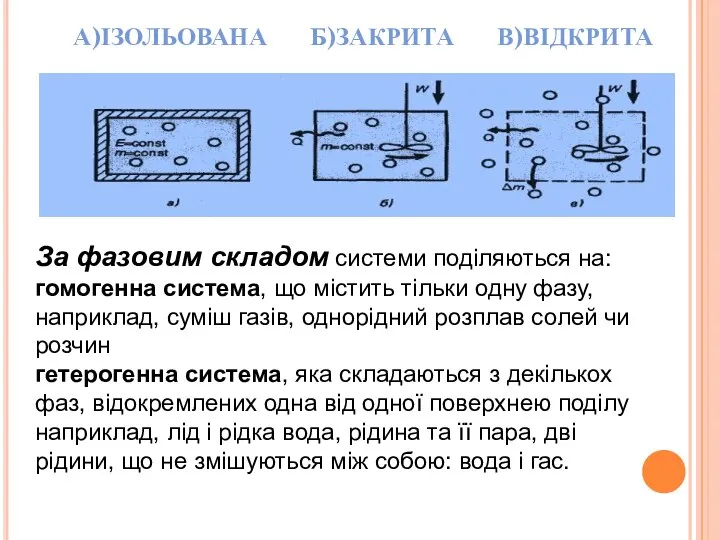
- 4. А)ІЗОЛЬОВАНА Б)ЗАКРИТА В)ВІДКРИТА За фазовим складом системи поділяються на:гомогенна система, що містить тільки одну фазу, наприклад,
- 5. Стан системи описується за допомогою фізичних величин, які називаються термодинамічними параметрами. Термодинамічні параметри – це певні
- 6. Залежно від сталості певних параметрів термодинамічні процеси поділяються на типи: ізобаричні (Р = const); ізохоричні (V
- 7. ВНУТРІШНЯ ЕНЕРГІЯ Внутрішня енергія – це функція стану, яка складається з усіх видів енергії системи. Внутрішня
- 8. ПЕРШИЙ ЗАКОН ТЕРМОДИНАМІКИ Теплота Q, що поглинається системою, йде на зміну її внутрішньої енергії (∆U) і
- 9. ТЕРМОХІМІЯ Термохімія – це розділ хімічної термодинаміки, що вивчає теплові ефекти хімічних реакцій та фазових перетворень.
- 10. Стандартні умови в термохімії: Р = 101325 Па, Т = 25ºС = 298 К , звідси
- 11. Наприклад. Одержання СО2 І спосіб: 1)С(тв.) + О2(г.) = СО2 (г.) ΔН1 утв(СО2) = - 393,6
- 12. Наслідок із закону Гесса. Тепловий ефект хімічного рівняння дорівнює сумі теплот утворення одержаних речовин (продуктів реакції)
- 13. Наприклад для реакції: 2NaOH(p.) + CO2(г.) = Na2CO3(тв.) + Н2О(р.) ∆Н0298 =? ∆Н0298хр = ((∆Н0298 (Na2CO3)
- 14. Задача. Складіть термохімічне рівняння і обчисліть стандартну ентальпію утворення SO2 , якщо при горінні 8 г
- 15. Задача. Визначити стандартну ентальпію утворення РН3, виходячи з рівняння: 2РН3(Г) + 4О2(Г)= Р2О5(к) +3Н2О(р); ΔН0298(х.р.)= -2360
- 16. ЗАДАЧА Скласти термохімічне рівняння реакції згоряння етанолу, якщо відомо, що при спалюванні 4,6г С2Н5ОН виділяється 136,7
- 17. ЕНТРОПІЯ (S) Самочинні процеси – це такі процеси, що перебігають без підведення енергії ззовні. Рушійними силами
- 18. ЯКІСНА ОЦІНКА ЗМІНИ ЕНТРОПІЇ Ентропія речовини у газоподібному стані істотно вища, ніж у рідкому і твердому
- 19. НЕ ЗДІЙСНЮЮЧИ РОЗРАХУНКІВ, УСТАНОВІТЬ ЗНАК ΔSْ298 НАСТУПНИХ ПРОЦЕСІВ: 1) 2NH3 (г.) = N2 (г.) + 3Н2
- 20. ΔS – ентропія, кількісна міра безпорядуку в системі. [S] = [Дж/(моль·К)] Задача. На основі довідникових даних
- 21. ЕНЕРГІЯ ГІББСА Ентальпійний і ентропійний фактори, що відображають дві протилежні тенденції, не можуть бути вичерпним критерієм
- 22. НАПРЯМ ПЕРЕБІГУ ХІМІЧНИХ РЕАКЦІЙ ΔG є критерій самочинного перебігу хімічної реакції, тому знак перед чисельним значенням
- 23. ΔG0298 (ПРОСТОЇ РЕЧ.) = 0 Якщо вихідні речовини і продукти реакції перебувають у стандартних станах, то
- 24. ЗАДАЧА. ОБЧИСЛІТЬ, ЧИ МОЖЕ МАГНІЙ ГОРІТИ В АТМОСФЕРІ ВУГЛЕКИСЛОГО ГАЗУ ПРИ Т = 298 К. СТАНДАРТНІ
- 25. АНАЛІЗ РІВНЯННЯ ΔG=ΔH−T⋅ΔS Екзотермічні реакції(ΔH 0. ΔG Якщо у результаті екзотермічної реакції(ΔH |TΔS|) і ΔG Ендотермічна
- 26. ВИЗНАЧИТИ, ЯКІ З РЕАКЦІЙ УТВОРЕННЯ ОКСИДІВ НІТРОГЕНУ І ПРИ ЯКИХ ТЕМПЕРАТУРАХ (ВИСОКИХ ЧИ НИЗЬКИХ) МОЖУТЬ В
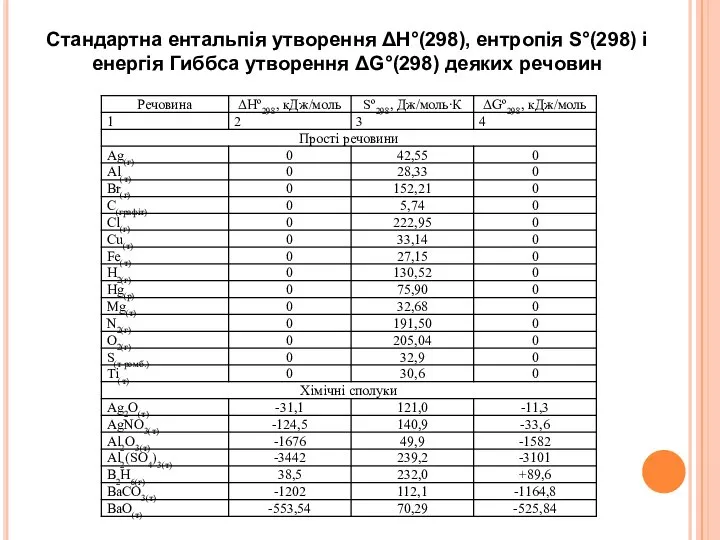
- 27. Стандартна ентальпія утворення ΔН°(298), ентропія S°(298) і енергія Гиббса утворення ΔG°(298) деяких речовин
- 29. Скачать презентацию

















![ΔS – ентропія, кількісна міра безпорядуку в системі. [S] = [Дж/(моль·К)] Задача.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/992445/slide-19.jpg)






 Эксперимент с духами
Эксперимент с духами Классификация органических веществ
Классификация органических веществ Решение задач с учетом примесей в веществе
Решение задач с учетом примесей в веществе Презентация тема 7.5. 7.6
Презентация тема 7.5. 7.6 Технология производства органических лекарственных веществ. Препараты алифатического ряда: хлороформ, йодоформ, хлоральгидрат
Технология производства органических лекарственных веществ. Препараты алифатического ряда: хлороформ, йодоформ, хлоральгидрат Непредельные углеводороды: алкены и алкины
Непредельные углеводороды: алкены и алкины Презентация на тему Алюминий как химический элемент и как простое вещество
Презентация на тему Алюминий как химический элемент и как простое вещество  Основания. Равновесия в растворах
Основания. Равновесия в растворах Закон сохранения массы веществ. Признаки химических реакций
Закон сохранения массы веществ. Признаки химических реакций Реакции по направлению процесса
Реакции по направлению процесса Реакции поликонденсации
Реакции поликонденсации Приложения для отслеживания проб ALS Geochemistry
Приложения для отслеживания проб ALS Geochemistry Соединения серы. Сернистая и серная кислоты
Соединения серы. Сернистая и серная кислоты Закон сохранения массы веществ
Закон сохранения массы веществ Основы переработки нефти и нефтепродуктов
Основы переработки нефти и нефтепродуктов Реакции обмена. Типы химических реакций
Реакции обмена. Типы химических реакций Замедленное коксование гудрона
Замедленное коксование гудрона Метод окислительно - восстановительного титрования
Метод окислительно - восстановительного титрования Ароматические углеводороды
Ароматические углеводороды Презентация на тему Кремний и его соединения
Презентация на тему Кремний и его соединения  1_Лекція Комплексн
1_Лекція Комплексн Взаимодействие элементов-неметаллов между собой. 8 класс
Взаимодействие элементов-неметаллов между собой. 8 класс Железо Fe
Железо Fe Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций Физические и химические явления
Физические и химические явления Жиры. Определение и общая формула
Жиры. Определение и общая формула Сплавы металлов
Сплавы металлов Кислородные соединения азота. Оксиды. Кислоты. Соли
Кислородные соединения азота. Оксиды. Кислоты. Соли