Слайд 2
ЛЕКЦИЯ №6
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИИ
ОП. 05 Химия
1 курс 1 семестр
Составитель: преподаватель
Кобзева Марина

Валерьевна
Ставрополь, 2020г
Слайд 3ТЭД
Все вещества делятся на электролиты и
неэлектролиты.
Электролиты - вещества, проводящие электрический

ток в растворенном или расплавленном состоянии.
Неэлектролиты - вещества, которые не проводят электрического тока в растворенном или расплавленном состоянии.
Слайд 4ТЭД
Электропроводность водных растворов электролитов объясняется теорией электролитической диссоциации.
ТЭД разработана в 1887 г.

швецким ученым С. Аррениусом и усовершенствана трудами русских ученых, особенно И.А. Каблуковым.
Слайд 5Основные положения ТЭД
Электролиты при растворении в воде частично или полностью распадаются на

положительно и отрицательно заряженные ионы:
NaCl Na+ + Cl-
Слайд 6Основные положения ТЭД
При пропускании электрического тока через раствор электролита
положительные ионы

направляются к отрицательно заряженному катоду (катионы),
отрицательно заряженные ионы - к полопжительно заряженному аноду (анионы).
Слайд 7Прохождение электрического тока через раствор электролита
Анод (+)
Катод
(-)
Электролит
Катион
Анион
+
+
_
_
+
_
+
+
_
_
_
_
_
+
_
+
+
А
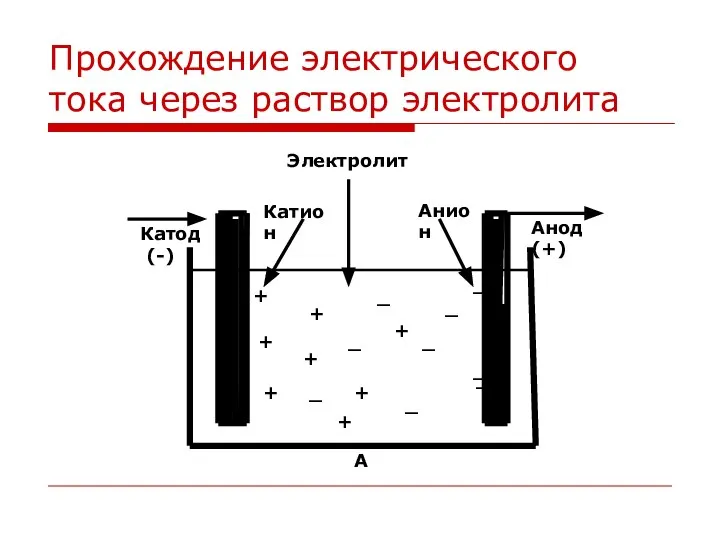
Слайд 8Прохождение электрического тока через раствор электролита
А –направленное движение катионов и анионов при

пропускании электрического тока через раствор электролита.
Слайд 9Основные положения ТЭД
Раствор в целом является электронейтральным, т.к. сумма положительных и отрицательных

зарядов равна нулю.
Диссоциация относится к обратимым процессам. Процесс диссоциации состоит из двух взаимосвязанных процессов - распада молекул на ионы (ионизация) и процесса соединения ионов в молекулы (моляризация):
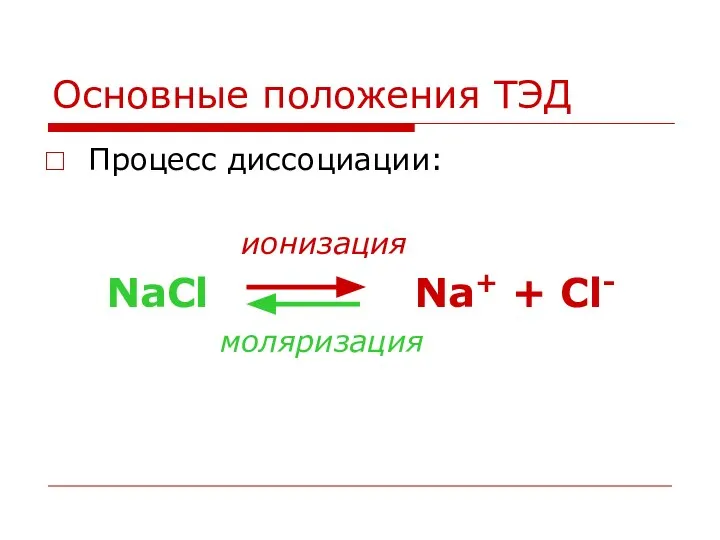
Слайд 10Основные положения ТЭД
Процесс диссоциации:
ионизация
NaCl Na+ + Cl-
моляризация
Слайд 11Основные положения ТЭД
Ионы представляют собой заряженные частицы.
Атомы и молекулы - электронейтральны

и различны по физическим и химическим свойствам.
Слайд 12Степень электролитической диссоциации
Электролиты обладают различной способностью к диссоциации.
Степень диссоциации (α) -это отношение

числа молекул, распавшихся на ионы (n), к общему числу растворенных молекул электролита (n0):
α = n / n0.
Слайд 13Степень электролитической диссоциации
Степень диссоциации выражается или в десятичных дробях или, чаще,

в процентах:
Если α = 1, или 100 %, электролит полностью диссоциирует на ионы.
Если α = 0,5, или 50 %, то из каждых 100 молекул данного электролита 50 находятся в состоянии диссоциации.
Слайд 14Сильные и слабые электролиты
В зависимости от α различают:
Сильные электролиты, их

α в 0,1 н. растворе выше 30 %.
Диссоциируют практически полностью.
Слайд 15Сильные и слабые электролиты
Относятся:
почти все соли;
многие минеральные кислоты: H2SO4, HNO3,

HCl, HClO4, HBr, HJ, HMnO4 и др.
основания щелочных металлов и некоторых щелочноземельных металлов: Ba(OH)2 и Ca(OH)2.
Слайд 16Сильные и слабые электролиты
Средние электролиты, их α от 3 до 30 %.

К ним относятся кислоты H3PO4, H2SO3, HF и т.д.
Слайд 17Сильные и слабые электролиты
Слабые электролиты в водных растворах диссоциированы лишь частично, их

α менее 3 %.
Относятся:
некоторые минеральные кислоты: H2CO3, H2S, H2SiO3, HCN ;
Слайд 18Сильные и слабые электролиты
почти все органические кислоты;
многие основания металлов (кроме оснований

щелочных и щелочноземельных металлов), а также гидроксид аммония;
некоторые соли: HgCl2, Hg(CN)2.
Слайд 19Факторы, влияющие на α
Природа растворителя:
►Чем больше диэлектрическая постоянная растворителя, тем больше

степень диссоциации электролита в нем.
Слайд 20Факторы, влияющие на α
Концентрация раствора:
Степень диссоциации электролита увеличивается при разбавлении раствора.
При

увеличении концентрации раствора уменьшается степень диссоциации (частое столкновение ионов).
Слайд 21Факторы, влияющие на α
Природа электролита:
► Диссоциация электролита зависит от степени диссоциации.

Слайд 22Факторы, влияющие на α
Температура:
►У сильных электролитов с повышением температуры α уменьшается,

т.к. увеличивается число столкновений между ионами.
►У слабых электролитов при повышении температуры α вначале повышается, а после 6000 С начинает уменьшаться.
Слайд 23Константа электролмтической диссоциации
В растворах слабых электролитов при диссоциации устанавливается динамическое равновесие между

молекулами и ионами:
CH3COOH + H2O ↔ CH3COO- + H3O+
[CH3COO-].[ H3O+] / [CH3COOH] =Кдисс
Слайд 24Константа электролмтической диссоциации
Кдисс - это произведение концентрации ионов, распавшихся на ионы, деленное

на концентрацию молекул, растворенных в воде.
K - константа диссоциации слабых электролитов.
Слайд 25Выражение в общем виде:
KnAm ↔ nK+ + mA-
Kдисс = [K+]n .[
![Выражение в общем виде: KnAm ↔ nK+ + mA- Kдисс = [K+]n .[ A-] / [KnAm]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/975671/slide-24.jpg)
A-] / [KnAm]
Слайд 26Диссоциация воды
Вода является одним из наименее диссоциированных веществ., но все же диссоциирует
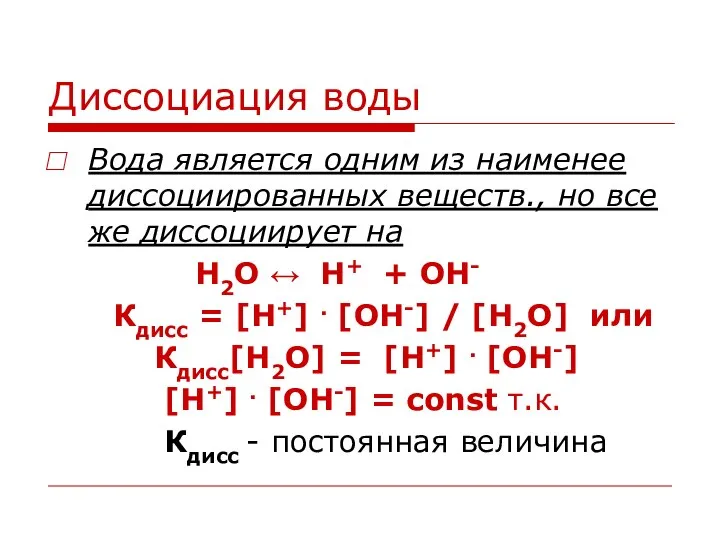
на
H2O ↔ H+ + OH-
Кдисс = [H+] . [OH-] / [H2O] или
Кдисс[H2O] = [H+] . [OH-]
[H+] . [OH-] = const т.к.
Кдисс - постоянная величина
Слайд 27Диссоциация воды
Ионное произведение воды (Kw) - произведение концентрации ионов H+ и

OH- в воде и водных растворах является постоянной величиной при постоянной температуре:
Kw = [H+] . [OH-]
При 2200 С в воде и водных растворах
Kw = 1 . 10-14
Слайд 28Определение кислотности среды
Для характеристики кислотности растворов применяют вместо истинных концентраций водородных и

гидроксидных ионов их логарифмы, взятые с обратным знаком.
Эти величины называют ионными показателями и обозначают буквой p.
Слайд 29Определение кислотности среды
Водородный показатель:
pH = - lg[H+]
Гидроксидный показатель:
pOH = -lg[OH]-
![Определение кислотности среды Водородный показатель: pH = - lg[H+] Гидроксидный показатель: pOH = -lg[OH]-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/975671/slide-28.jpg)
Слайд 30Определение кислотности среды
Ионное произведение воды Kw = 10-14
Логарифм выражения ионного произведения

воды:
lg[H+][OH-] = -14
Все величины с обратным знаком:
-lg[H+] + (-lg[OH-]) = -14
рН + рОН = 14
Слайд 31Определение кислотности среды
С помощью последнего уравнения рассчитывают рОН, и наоборот,
Например,

в растворе рН = 5, тогда
рОН = 14 - 5 = 9.
Кислотность растворов характеризуют количественно через величину рН:
Слайд 32Определение кислотности среды
нейтральный раствор – рН = 7;
кислый раствор - рH <

7;
щелочной раствор - рН > 7.
Слайд 33Диссоциация кислот
Кислоты – это электролиты образующие при диссоциации в водных растворах катионы

водорода
HCl ↔ H+ + Cl-
H2SO4 ↔ 2H+ + SO42-
Слайд 34Диссоциация оснований
Основания – это электролиты образующие при диссоциации в водных растворах анионы

гидроксила.
NaOH ↔ Na+ + OH-
Ba(OH)2 ↔ Ba2+ + 2OH-
Слайд 35Диссоциация солей
Соли – это электролиты образующие при диссоциации в водных растворах катионы

металлов (аммония) и анионы кислотных остатков.
NaCl ↔ Na+ + Cl-
(NH4)2SO4 ↔ 2NH4++ SO42-
Слайд 36Реакции ионного обмена
Реакции между ионами направлены в сторону образования трудносрастворимых или малодиссоциирующих

веществ.
Уравнения этих реакций могут быть представлены в молекулярной и ионной форме.
Слайд 37Реакции ионного обмена
Реакции ионного обмена – это реакции которые идут до конца,

в результате которых образуются осадок, газ, малодиссоциирующее вещество.























![Выражение в общем виде: KnAm ↔ nK+ + mA- Kдисс = [K+]n .[ A-] / [KnAm]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/975671/slide-24.jpg)



![Определение кислотности среды Водородный показатель: pH = - lg[H+] Гидроксидный показатель: pOH = -lg[OH]-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/975671/slide-28.jpg)












 Окислительно- восстановительные реакции в органической химии. Подготовка к ЕГЭ
Окислительно- восстановительные реакции в органической химии. Подготовка к ЕГЭ Классификация химических реакций
Классификация химических реакций Гипер-гипофосфатемия
Гипер-гипофосфатемия Ароматические углеводороды. Галогенопроизводные
Ароматические углеводороды. Галогенопроизводные Вязкоупругие свойства полимеров
Вязкоупругие свойства полимеров Презентация на тему Классы неорганических веществ
Презентация на тему Классы неорганических веществ  4505ab8713f54e72bb388461c5e134ac (1)
4505ab8713f54e72bb388461c5e134ac (1) Электролитическая диссоциация
Электролитическая диссоциация Основы материаловедения. Раздел 1
Основы материаловедения. Раздел 1 Природные источники углеводородов. Домашняя работа. 10 класс
Природные источники углеводородов. Домашняя работа. 10 класс Подготовка к контрольной работе
Подготовка к контрольной работе 9. Потомки светоносного элемента
9. Потомки светоносного элемента Химические реакции
Химические реакции Нихром. Физические свойства
Нихром. Физические свойства Газообразные вещества и их применение
Газообразные вещества и их применение Увлекательный мир химии
Увлекательный мир химии Основные понятия и законы химии
Основные понятия и законы химии Реакции разложения
Реакции разложения Применение кислорода
Применение кислорода Оксиды в свете ТЭД
Оксиды в свете ТЭД Химическая кинетика. Экзаменационные вопросы
Химическая кинетика. Экзаменационные вопросы Коррозия металлов. Лекция №8
Коррозия металлов. Лекция №8 Презентация на тему Применение радиоактивных изотопов в археологии
Презентация на тему Применение радиоактивных изотопов в археологии  Презентация Повторение к СОЧ-10 кл (1)
Презентация Повторение к СОЧ-10 кл (1) Материаловедение. Влияние нагрева на структуру деформированного металла. (Тема 5)
Материаловедение. Влияние нагрева на структуру деформированного металла. (Тема 5) Тотығу - тотықсыздану реакциясы
Тотығу - тотықсыздану реакциясы Мои НИОКР металлорганической химии против рака, Альцгеймера и Паркинсона
Мои НИОКР металлорганической химии против рака, Альцгеймера и Паркинсона Оксид серы (VI) SO3
Оксид серы (VI) SO3